Руководство Европейского общества кардиологов по хроническим коронарным синдромам (2019): обзор основных рекомендаций по антитромботической терапииИшемическая болезнь сердца (ИБС) – хронический патологический процесс, в основе которого лежит прогрессирующий атеросклероз коронарных артерий. ИБС характеризуется длительными периодами стабильного течения с риском дестабилизации, которая может развиться в любой момент, чаще всего вследствие острого атеротромбоза, вызванного разрывом или эрозией коронарной атеросклеротической бляшки. Разнообразные проявления ИБС принято объединять в две большие группы под названием острые (ОКС) и хронические (ХКС) коронарные синдромы. К ОКС, как известно, относят нестабильную стенокардию и острый инфаркт миокарда (ИМ) с подъемом или без подъема сегмента ST. В свою очередь, пациентов с ХКС предлагается подразделять на следующие основные группы [1]: 1) пациенты с подозрением на наличие ИБС и симптомами стабильной стенокардии и/или одышкой; 2) пациенты с впервые развившейся сердечной недостаточностью (СН) или дисфункцией левого желудочка и подозрением на ИБС; 3) бессимптомные и симптоматические пациенты со стабилизированными симптомами через <1 год после ОКС или пациенты после недавней реваскуляризации; 4) бессимптомные и симптоматические пациенты через >1 год после диагностики ИБС или реваскуляризации; 5) пациенты со стенокардией и подозрением на вазоспастический или микрососудистый вариант ИБС; 6) бессимптомные пациенты с ИБС, обнаруженной во время скринингового обследования. Все эти клинические сценарии классифицируются как ХКС, но связаны с различной степенью риска будущих сердечно-сосудистых (СС) событий, включая риски смерти или ИМ, которые могут меняться с течением времени. С одной стороны, риск СС событий может возрастать вследствие недостаточного контроля факторов СС риска, неоптимальной модификации образа жизни и/или медикаментозной терапии или неудачной реваскуляризации миокарда. С другой – СС риск может быть снижен благодаря успешной реваскуляризации и соответствующей вторичной профилактике, в частности грамотно организованной антитромботической (антиагреганты ± антикоагулянты) терапии. В опубликованном экспертами Европейской ассоциации кардиологов (ESC) в 2019 г. руководстве по ведению пациентов с ХКС изложены современные представления об адекватной антитромботической терапии при этой клинической форме ИБС [1]. Основные положения этого раздела руководства будут кратко представлены в настоящем обзоре.
Антиагрегантные препараты Доказанная ключевая роль активации и агрегации тромбоцитов в развитии симптоматического коронарного тромбоза обосновывает применение антиагрегантов у пациентов с ХКС при условии благоприятного баланса между противоишемической эффективностью такой терапии и связанным с ней повышенным геморрагическим риском. Как следствие, двойная антиагрегантная терапия (ДАТ) комбинацией ацетилсалициловой кислоты (АСК) и перорального ингибитора P2Y12-рецепторов тромбоцитов является основой антитромботической терапии у пациентов после ИМ и/или чрескожного коронарного вмешательства (ЧКВ). Для профилактики ишемических событий используют низкие дозы АСК, которые обеспечивают необратимое торможение циклооксигеназы- 1 тромбоцитов и, как следствие, подавляют производство тромбоксана. Применение более высоких доз АСК сопровождается повышением риска желудочно- кишечных побочных эффектов, поэтому рекомендованной суточной дозой АСК для пациентов с ИБС, независимо от анамнеза ИМ, в настоящее время является доза 75–100 мг/сут [2–4]. Поскольку ингибирование циклооксигеназы- 1 под действием АСК является стабильным и предсказуемым эффектом, нет необходимости проводить мониторинг ответа на лечение при помощи оценки функции тромбоцитов [5]. Другие неселективные нестероидные противовоспалительные препараты, такие как ибупрофен, тоже обратимо ингибируют циклооксигеназу-1, однако неблагоприятное влияние на СС риск препятствует их использованию в качестве альтернативы АСК, например, у пациентов с непереносимостью АСК. Пероральные ингибиторы P2Y12-рецепторов тромбоцитов блокируют рецептор, который играет ключевую роль в активации тромбоцитов и ускорении формирования артериального тромба. К представителям этого класса относятся пролекарства клопидогрель и прасугрел (производные тиенопиридина), которые необратимо блокируют P2Y12-рецепторы после превращения в печени с образованием активных метаболитов, а также тикагрелор – антиагрегант, обратимо связывающий P2Y12-рецепторы и не требующий метаболической активации. В исследовании CAPRIE было обнаружено небольшое общее преимущество клопидогреля перед АСК в профилактике СС событий у пациентов, ранее перенесших ИМ, инсульт или лиц с заболеванием периферических артерий (ЗПА), при сопоставимом профиле безопасности антиагрегантов [6]. При назначении клопидогреля следует учитывать, что его функциональная активность может быть ограничена различными фармакодинамическими процессами, связанными с вариабельными результатами превращения пролекарства в активный метаболит (в некоторых случаях генетически детерминированными наличием «медленного» аллеля гена CYP2C19), что приводит к недостаточной эффективности клопидогреля у некоторых пациентов [5]. Кроме того, причиной снижения эффективности клопидогреля может стать прием препаратов, ингибирующих CYP2C19, таких как ингибитор протонной помпы омепразол [7]. Прасугрел имеет более быстрый, предсказуемый и в среднем более выраженный антиагрегантный эффект по сравнению с клопидогрелем, он не вступает в лекарственные взаимодействия и не подвержен эффекту потери функции в результате вариабельности гена CYP2C19. По данным исследований TRITONTIMI 38 и TRILOGY ACS, прасугрел (в комбинации с АСК) обладает большей эффективностью, чем клопидогрель (в комбинации с АСК) у пациентов после ОКС и ЧКВ, но не у пациентов, получающих консервативное лечение ОКС [8, 9]. Кроме того, в исследовании TRITON-TIMI 38 применение прасугрела было связано с увеличением частоты нефатальных и фатальных кровотечений по сравнению с клопидогрелем у пациентов с ОКС, перенесших ЧКВ, с преобладанием вредных эффектов над полезными у лиц с анамнезом ишемического инсульта и отсутствием очевидной пользы у людей в возрасте >75 лет или с массой тела <60 кг [8]. Из всех пероральных ингибиторов P2Y12-рецепторов тикагрелор характеризуется самым предсказуемым и высоким уровнем ингибирования функции тромбоцитов во время поддерживающей терапии у пациентов, приверженных лечению [10], он также отличается более быстрым началом и более быстрым и предсказуемым завершением эффекта по сравнению с клопидогрелем [11, 12]. При использовании в качестве монотерапии у пациентов после ЧКВ в исследовании GLOBAL LEADERS тикагрелор и АСК обеспечивали сопоставимую эффективность и безопасность терапии [13]. В исследовании PLATO применение тикагрелора (нагрузочная доза 180 мг, поддерживающая доза 90 мг 2 раза в день) по сравнению с клопидогрелем было связано с более выраженным снижением риска ишемических событий у пациентов с ОКС, получавших АСК, независимо от стратегии реваскуляризации, наряду с повышением риска нефатальных кровотечений [14, 15]. В исследовании PEGASUS-TIMI 54 тикагрелор в дозах 90 или 60 мг 2 раза в сутки обеспечивал снижение 3-летней общей частоты ИМ, инсульта или смерти от СС причин по сравнению с плацебо при лечении стабильных пациентов, перенесших ИМ 1–3 года назад и получающих АСК [16]. Обе дозы тикагрелора увеличивали риск нефатальных кровотечений. Эквивалентные профили эффективности и безопасности двух доз тикагрелора объяснялись аналогичной степенью подавления функции тромбоцитов [17]. Кроме повышения геморрагического риска к побочным эффектам тикагрелора относится одышка, которая в некоторых случаях может привести к необходимости замены тикагрелора на один из тиенопиридиновых антиагрегантов. Также следует учитывать, что в метаболизме тикагрелора участвует фермент CYP3A, поэтому тикагрелор не следует использовать с сильными ингибиторами или индукторами CYP3A. Оптимальные сроки начала приема ингибиторов P2Y12-рецепторов перед выполнением коронарной ангиографии и, потенциально, ЧКВ у пациентов с ХКС неопределены, однако клинический опыт свидетельствует в пользу предварительного назначения клопидогреля пациентам, у которых с высокой долей вероятности будут выявлены показания к проведению ЧКВ [16]. Ограниченные результаты фармакодинамических исследований поддерживают использование прасугрела или тикагрелора у стабильных пациентов при плановом ЧКВ и высоком риске тромбоза стента (незарегистрированное показание для обоих препаратов), однако баланс «безопасность/ эффективность» такого подхода по сравнению с приемом клопидогреля до настоящего времени не изучен [18]. Было показано, что после ЧКВ по поводу стабильной стенокардии 6-месячная ДАТ обеспечивает оптимальный баланс эффективности и безопасности у большинства пациентов [16]. Преждевременная отмена ингибитора P2Y12-рецептора связана с повышенным риском тромбоза стента и потому не рекомендуется [16]. Тем не менее более короткая продолжительность ДАТ может быть целесообразной у лиц с высоким риском угрожающих жизни кровотечений ввиду очень низкого риска тромбоза стента через 1–3 мес после ЧКВ [16]. На основании результатов клинических исследований фазы III, после ОКС обычно рекомендуется 12-месячная ДАТ, однако при высоком риске кровотечений более короткая ДАТ может быть целесообразной и для этих пациентов [16]. В то же время, согласно результатам исследования DAPT с участием пациентов, перенесших ЧКВ, применение клопидогреля или прасугрела более 12 мес после ЧКВ уменьшает риск ишемических событий и тромбоза стента, не влияя на риск смерти, но увеличивая риск кровотечений [19]; при этом пролонгированная терапия с применением прасугрела или клопидогреля была более полезна пациентам после ИМ [20]. В вышеупомянутом исследовании PEGASUS-TIMI 54 было показано, что пролонгированная терапия тикагрелором в дозе 60 или 90 мг 2 раза в день у стабильных пациентов через год и более после ИМ способствует снижению риска ишемических событий наряду с увеличением частоты нефатальных кровотечений [16]. Доза 60 мг продемонстрировала лучшую переносимость, в связи с чем была одобрена во многих странах для применения по этому показанию в указанной выборке пациентов. Анализ в подгруппах продемонстрировал более выраженное абсолютное снижение риска ишемических событий при длительном приеме тикагрелора (60 мг 2 раза в день) у постинфарктных пациентов с сахарным диабетом (СД), ЗПА или многососудистой ИБС из группы высокого риска [21, 22]. Риск кровотечения является важным параметром, который должен оцениваться у пациентов с ХКС и высоким ишемическим риском, которым может быть полезна долгосрочная и/или интенсивная антитромбоцитарная терапия. В качестве клинического инструмента для поддержки процесса принятия терапевтических решений у пациентов после имплантации стента эксперты ESC предлагают использовать шкалу PRECISEDAPT (Predicting Bleeding Complication in Patients Undergoing Stent Implantation and Subsequent Dual Antiplatelet Therapy) [23]. Расчет показателя PRECISE-DAPT включает пять пунктов (уровень гемоглобина, количество лейкоцитов, возраст, клиренс креатинина, анамнез кровотечений, рис.), оценка ≥25 баллов связана с высоким уровнем геморрагического риска на фоне антитромбоцитарной терапии. 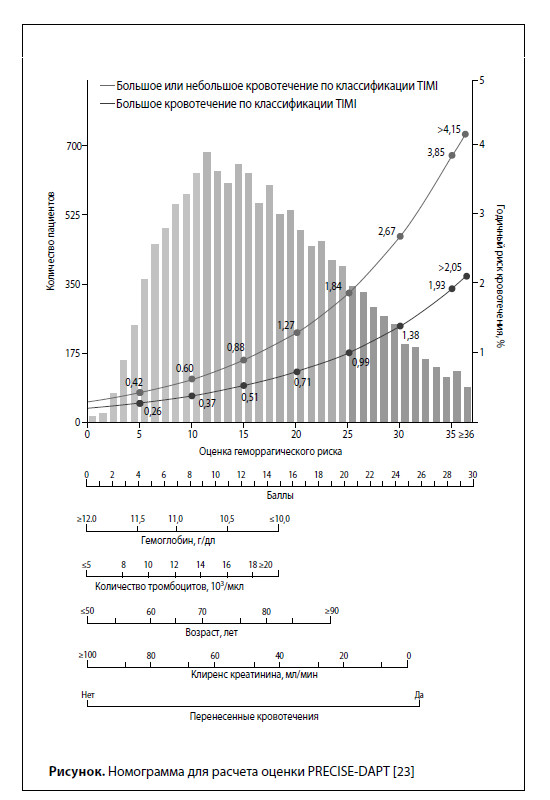 Антикоагулянтная терапия 1. Пациенты с ХКС и синусовым ритмом Как известно, антикоагулянтные препараты подавляют активность и/или образование тромбина, который играет ключевую роль как в процессе коагуляции, так и активации тромбоцитов, что приводит к снижению риска развития артериальных и венозных тромбозов. Тем не менее доказанная высокая эффективность и безопасность ДАТ по сравнению с комбинацией АСК + антикоагулянт (АК) в профилактике тромбоза стента привели к тому, что именно ДАТ стала стандартным подходом к лечению пациентов после ЧКВ [16]. Применение комбинации антиагрегантной терапии и стандартных доз варфарина или апиксабана с целью вторичной профилактики ишемических событий после перенесенного ОКС было связано с неблагоприятным соотношением «польза/риск» за счет повышения риска кровотечений [24, 25]. Однако последние исследования возродили интерес к применению комбинации антиагрегант + АК с использованием более низких доз антикоагулянтных препаратов. Ривароксабан. Возможность использования низкой дозы ривароксабана (2,5 мг 2 раза в день, четверть стандартной дозы, используемой для антикоагуляции у пациентов с фибрилляцией предсердий [ФП]) изучали в нескольких выборках пациентов с синусовым ритмом. В исследовании ATLAS ACS 2-TIMI 51 низкая доза ривароксабана по сравнению с плацебо снижала риск комбинированной конечной точки, включающей ИМ, инсульт и СС смерть, у стабилизированных пациентов с ОКС, получавших АСК и клопидогрель; этот эффект ривароксабана сопровождался повышением риска кровотечений и, одновременно, снижением СС смертности в исследуемой выборке пациентов [26]. Впоследствии в исследовании COMPASS применение низкой дозы ривароксабана в комбинации с АСК сравнивали с монотерапией АСК и с монотерапией ривароксабаном в дозе 5 мг 2 раза в день у пациентов с ХКС или ЗПА. Результаты исследования выявили снижение риска ишемических событий при повышенном риске нефатальных кровотечений в группе комбинированной терапии [27]. Более выраженное абсолютное снижение ишемического риска отмечалось у пациентов из группы повышенного риска с СД, ЗПА или среднетяжелой хронической болезнью почек (ХБП), а также у курильщиков. В исследовании GEMINI-ACS ривароксабан 2,5 мг 2 раза в день сравнивали с АСК у стабильных пациентов после ЧКВ, получавших ингибитор P2Y12-рецепторов. Полученные результаты свидетельствуют о сопоставимой безопасности низкой дозы ривароксабана и АСК в этой клинической ситуации, однако, чтобы сделать окончательные выводы, необходимы более масштабные исследования [28]. Кроме того, нет данных о безопасности выполнения ЧКВ без предварительного применения АСК. 2. Пациенты с ХКС и ФП Антикоагулянтная терапия рекомендуется пациентам с ФП и ХКС для снижения риска ишемического инсульта и других ишемических событий. У пациентов с ФП антикоагулянты эффективнее предотвращали развитие инсульта по сравнению с монотерапией АСК и ДАТ на основе клопидогреля и поэтому рекомендуются к использованию при этом варианте нарушения сердечного ритма [29]. При появлении показаний к назначению пероральных АК (ОАК) у пациентов с ФП, подходящих для назначения NOAC (ОАК, не влияющие на витамин К – апиксабан, дабигатран, эдоксабан или ривароксабан), NOAC имеют преимущество перед антагонистами витамина К (АВК) [29]. Комбинированная антитромботическая терапия после ЧКВ у пациентов с показаниями к назначению ОАК. До настоящего времени не было проведено ни одного исследования, специально сфокусированного на пациентах с ХКС и ФП, проходящих ЧКВ, поэтому клинические решения должны основываться на результатах исследований антитромботической терапии, включавших большую долю пациентов с ФП и ОКС, проходящих ЧКВ. В такой клинической ситуации (выполнение ЧКВ у пациентов с ФП и ХКС) следует по возможности избегать перерыва в приеме АВК в перипроцедурном периоде, при этом рекомендуется прекратить прием NOAC за 12–48 ч до планового ЧКВ, в зависимости от функции почек и схемы приема NOAC. Кроме того, предпочтительно использовать радиальный доступ с интрапроцедурным введением нефракционированного гепарина (НФГ) в стандартной дозе (70–100 Ед/кг); если пациент продолжает получать АВК, дозу НФГ снижают до 30–50 Ед/кг [30]. Перед процедурой рекомендуется прием АСК в дозе 75–100 мг/сут и клопидогреля (пациентам, не получавшим до ЧКВ поддерживающую дозу клопидогреля, рекомендована нагрузочная доза 300–600 мг), при этом последний имеет преимущество перед прасугрелом и тикагрелором [30]. У пациентов на АВК, получающих АСК и клопидогрель после ЧКВ, необходимо поддерживать значение международного нормализованного отношения (МНО) на уровне 2,0–2,5 и стремиться, чтобы этот показатель находился в терапевтическом диапазоне в течение >70% времени [30]. Одно из последних исследований антикоагулянтов у пациентов, перенесших ЧКВ, AUGUSTUS (An Open-label, 2х2 Factorial, Randomized Controlled, Clinical Trial to Evaluate the Safety of Apixaban vs. Vitamin K Antagonist and Aspirin vs. Aspirin Placebo in Patients With Atrial Fibrillation and Acute Coronary Syndrome or Percutaneous Coronary Intervention) показало, что применение апиксабана 5 мг 2 раза в день (доза, одобренная для тромбопрофилактики при ФП) было связано со значительно меньшим риском больших или клинически значимых небольших кровотечений по сравнению с АВК, и что применение АСК по сравнению с плацебо было связано со значительно более высоким геморрагическим риском. По результатам этого исследования самой безопасной стратегией для лечения пациентов с ФП и ОКС или ЧКВ, было признано применение апиксабана (без АСК) в дополнение к ингибитору P2Y12-рецепторов (преимущественно клопидогрелю) [31]. Тем не менее, было отмечено численное, статистически не значимое увеличение частоты тромбоза стента на фоне применения плацебо по сравнению с АСК, хотя для оценки межгрупповых различий по этому исходу исследование было недостаточно мощным. Как следствие, если ишемический риск преобладает над геморрагическим, то на период, пока сохраняется такое соотношение рисков, пациентам рекомендуется тройная антитромботическая терапия (ОАК, АСК и клопидогрель, ≥1 мес). Доказательств в поддержку применения двойной терапии ОАК и тикагрелором/ прасугрелом вместо тройной антитромботической терапии после ЧКВ у пациентов с показаниями к ОАК в настоящее время недостаточно.
В качестве длительной антитромботической терапии пациентам с ФП (или другими показаниями к приему ОАК), перенесшим ЧКВ, рекомендована монотерапия ОАК, которая начинается через 6–12 мес после вмешательства. Данных в поддержку длительного применения комбинации ОАК + антиагрегант недостаточно, однако у отдельных пациентов с высоким ишемическим риском можно рассматривать применение двойной терапии комбинацией ОАК + АСК или ОАК + клопидогрель [30].
Кардиохирургические вмешательства и антитромботическая терапия При выполнении кардиохирургической операции у пациентов с ХКС прерывать прием АСК обычно не рекомендуется, в то время как прием других антитромботических препаратов временно прекращается, при этом продолжительность интервала между моментом временной отмены препарата и вмешательством зависит от продолжительности действия и показаний к применению препарата (прасугрел за ≥7 дней, клопидогрель за ≥5 дней, тикагрелор за ≥3 дня, ривароксабан, апиксабан, эдоксабан и дабигатран за 1–2 дня до операции в зависимости от дозы и почечной функции). Прием АСК после операции аортокоронарного шунтирования (АКШ) может улучшить проходимость шунта [32], в то же время эффективность ДАТ или двойной терапии комбинацией АСК + ривароксабан после АКШ не определена, поскольку отсутствуют крупные проспективные исследования этой стратегии. Тем не менее есть данные о более высокой проходимости шунтов при использовании ДАТ по сравнению с монотерапией АСК после АКШ [16, 33, 34].
Некардиохирургические вмешательства и антитромботическая терапия Некардиохирургические вмешательства на фоне ХКС связаны с повышенным риском развития ИМ. Поэтому после ЧКВ проведение плановых операций рекомендуется по возможности откладывать до завершения рекомендуемого срока ДАТ. Обычно это означает отсрочку операции на 6 мес после проведения ЧКВ, однако, если операция будет проводиться многопрофильной бригадой специалистов, включающей (при необходимости) интервенционного кардиолога, то ее можно провести в интервале между 3-м и 6-м месяцем после ЧКВ. Большинство операций не требуют отмены АСК, поскольку польза препарата, связанная с профилактикой ишемических событий, перевешивает риск кровотечений. Исключением являются вмешательства с очень высоким геморрагическим риском (внутричерепные процедуры, трансуретральная простатэктомия, внутриглазные процедуры и др.) [16]. С полным текстом руководства на английском языке можно ознакомиться на официальном сайте ESC по адресу https://www.escardio.org/. Литература: 1. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal (2019) 00, 1-71, doi:10.1093/eurheartj/ehz425. 2. CURRENT-OASIS 7 Investigators, Mehta S., Bassand J., Chrolavicius S. et al. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med 2010; 363: 930-942. 3. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71-86. 4. Antithrombotic Trialists’ (ATT) Collaboration, Baigent C., Blackwell L., Collins R. et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373: 1849-1860. 5. Aradi D., Storey R., Komocsi A. et al.; Working Group on Thrombosis of the European Society of Cardiology. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014; 35: 209-215. 6. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329-1339. 7. Agewall S., Cattaneo M., Collet J. et al. ESC Working Group on Cardiovascular Pharmacology and Drug Therapy and ESC Working Group on Thrombosis. Expert position paper on the use of proton pump inhibitors in patients with cardiovascular disease and antithrombotic therapy. Eur Heart J 2013; 34: 1708-1713. 8. Wiviott S., Braunwald E., McCabe C. et al.; TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001-2015. 9. Roe M., Armstrong P., Fox K. et al. TRILOGY ACS Investigators. Prasugrel versus clopidogrel for acute coronary syndromes without revascularization. N Engl J Med 2012; 367: 1297-1309. 10. Zhang H., Yuan X., Zhang H. et al. Efficacy of long-term beta-blocker therapy for secondary prevention of long-term outcomes after coronary artery bypass grafting surgery. Circulation 2015; 131: 2194-2201. 11. Gurbel P., Bliden K., Butler K. et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/ OFFSET study. Circulation 2009; 120: 2577-2585. 12. Storey R., Bliden K., Ecob R. et al. Earlier recovery of platelet function after discontinuation of treatment with ticagrelor compared with clopidogrel in patients with high antiplatelet responses. J Thromb Haemost 2011; 9: 1730-1737. 13. Vranckx P., Valgimigli M., Windecker S. et al. Long-term ticagrelor monotherapy versus standard dual anti- platelet therapy followed by aspirin monotherapy in patients undergoing biolimus-eluting stent implantation: rationale and design of the GLOBAL LEADERS trial. EuroIntervention 2016; 12: 1239-1245. 14. Wallentin L., Becker R., Budaj A. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045-1057. 15. Wallentin L., Lindholm D., Siegbahn A. et al. PLATO study group. Biomarkers in relation to the effects of ticagrelor in comparison with clopidogrel in non-ST-elevation acute coronary syndrome patients managed with or without in-hospital revascularization: a substudy from the Prospective Randomized Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation 2014; 129: 293-303. 16. Valgimigli M., Bueno H., Byrne R. et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018; 39: 213-260. 17. Storey R., Angiolillo D., Bonaca M. et al. Platelet inhibition with ticagrelor 60 mg versus 90 mg twice daily in the PEGASUS-TIMI 54 trial. J Am Coll Cardiol 2016; 67: 1145-1154. 18. Orme R., Parker W., Thomas M. et al. Study of two dose regimens of ticagrelor compared with clopidogrel in patients undergoing percutaneous coronary intervention for stable coronary artery disease (STEEL-PCI). Circulation 2018; 138: 1290-1300. 19. Mauri L., Kereiakes D., Yeh R. et al. DAPT Study Investigators. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371: 2155-2166. 20. Yeh R., Kereiakes D., Steg P. et al.; DAPT Study Investigators. Benefits and risks of extended duration dual antiplatelet therapy after PCI in patients with and without acute myocardial infarction. J Am Coll Cardiol 2015; 65: 2211-2221. 21. Bhatt D., Bonaca M., Bansilal S. et al. Reduction in ischemic events with ticagrelor in diabetic patients with prior myocardial infarction in PEGASUS-TIMI 54. J Am Coll Cardiol 2016; 67: 2732-2740. 22. Bonaca M., Bhatt D., Storey R. et al. Ticagrelor for prevention of ischemic events after myocardial infarction in patients with peripheral artery disease. J Am Coll Cardiol 2016; 67: 2719-2728. 23. 2019 ESC Guidelines on the diagnosis and management of chronic coronary syndromes: supplementary data The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal (2019) 00, 1-19. doi:10.1093/eurheartj/ehz425. 24. Alexander J., Lopes R., James S. et al. APPRAISE-2 Investigators. Apixaban with antiplatelet therapy after acute coronary syndrome. N Engl J Med 2011; 365: 699-708. 25. Hurlen M., Abdelnoor M., Smith P. et al. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347: 969-974. 26. Mega J., Braunwald E., Wiviott S. et al.; ATLAS ACS 2TIMI 51 Investigators. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366: 9-19. 27. Eikelboom J., Connolly S., Bosch J. et al.; COMPASS Investigators. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017; 377: 1319-1330. 28. Ohman E., Roe M., Steg P. ete al. Clinically significant bleeding with low-dose rivaroxaban versus aspirin, in addition to P2Y12 inhibition, in acute coronary syndromes (GEMINI-ACS-1): a double-blind, multicentre, randomised trial. Lancet 2017; 389: 1799-1808. 29. Kirchhof P., Benussi S., Kotecha D. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37: 2893-2962. 30. Lip G., Collet J., Haude M. et al. 2018 Joint European consensus document on the management of anti- thrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace 2019; 21: 192-193. 31. Lopes R., Heizer G., Aronson R. et al.; AUGUSTUS Investigators. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med 2019; 380: 1509-1524. 32. Sousa-Uva M., Storey R., Huber K. et al. ESC Working Group on Cardiovascular Surgery and ESC Working Group on Thrombosis. Expert position paper on the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2014; 35: 1510-1514. 33. Saw J., Wong G., Mayo J. et al. Ticagrelor and aspirin for the prevention of cardiovascular events after coronary artery bypass graft surgery. Heart 2016; 102: 763769. 34. Zhao Q., Zhu Y., Xu Z. et al. Effect of ticagrelor plus aspirin, ticagrelor alone, or aspirin alone on saphenous vein graft patency 1 year after coronary artery bypass grafting: a randomized clinical trial. JAMA 2018; 319: 1677-1686. Автор обзора: Виктор Мицьо  Medicine Review 2019; Спецвипуск (Кардіологічний альманах - 2019): 74 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |