Тромбоэмболия легочной артерии. Новые рекомендации ESC (2008)На главной кардиологической конференции – ежегодном конгрессе Европейского общества кардиологов (European Society of Cardiology, ESC), который в этом году проходил в Мюнхене (Германия) 31 августа – 2 сентября, – были представлены новые рекомендации ESC по диагностике, лечению и профилактике тромбоэмболии легочной артерии (ТЭЛА) [1]. Предыдущая версия руководства была опубликована в 2000 г. [2] и, учитывая существенное обновление доказательной базы в последние годы, требовала пересмотра. В обновлении 2008 г. руководство ESC акцентирует внимание на современных доступных и надежных методах диагностики ТЭЛА, прогнозировании риска, эффективных и безопасных методах лечения. Отдельный раздел документа посвящен особенностям ведения ТЭЛА в некоторых специфических клинических ситуациях – не только при беременности, как в руководстве 2000 г., но также и на фоне злокачественных заболеваний, в случае развития гепарининдуцированной тромбоцитопении, вкратце освещается проблема хронической посттромбоэмболической легочной гипертензии, уделено внимание и такому вопросу, как нетромботический легочной эмболизм (жировая, воздушная эмболия, эмболия амниотической жидкостью, внутрисосудистые инородные тела, септические эмболы и др.). Кроме того, в отличие от предыдущей версии руководства в рекомендациях 2008 г. указываются уровни доказательности не только для лечебных подходов, но и для диагностических, учитывая высокую значимость точной и своевременной диагностики ТЭЛА. В новом руководстве более четко обозначен рекомендуемый алгоритм обследования, причем он приведен в зависимости от стратификации риска. Основные положения новых рекомендаций ESC [1] представлены в этом обзоре. Актуальность ТЭЛА ТЭЛА – относительно распространенная сердечно-сосудистая патология. Точные статистические данные по заболеваемости и смертности от ТЭЛА на сегодняшний день неизвестны, однако примерно распространенность ТЭЛА, по данным 25-летнего популяционного исследования M.D. Silverstein et al. (1998), проведенного в штате Миннесота (США), оценивается как 1 случай на тысячу населения в год. Разные исследования показывают разные результаты – от 0,5 до 2 на тысячу населения в год. Так, по данным E.J. van Beek, J.W. ten Cate (1996), на которые преимущественно опирались авторы руководства ESC 2000 г. [2], распространенность ТЭЛА в западных странах составляла 0,5 на тысячу населения в год. В исследовании M. Nordstorn, B. Lindblad (1998) подсчитано, что ТЭЛА ежегодно встречается примерно у 2,08 на 1 тыс. жителей г. Мальмо (Швеция). По результатам популяционного исследования E. Oger (2000), проведенного в регионе Бретань (Франция), распространенность ТЭЛА была оценена как 0,6 на тысячу населения. Однако риск ТЭЛА резко возрастает у лиц, находящихся на стационарном лечении (независимо от диагноза). P.D. Stein et al. (2004) показали, что среди госпитализированных пациентов распространенность ТЭЛА в США достигает 0,4%. Другие исследования подтверждают, что в европейских странах ситуация среди больных стационаров примерно такая же. Наряду с этим количество нефатальных асимптомных тромбоэмболий легочного русла определить пока не удается. ТЭЛА – очень сложная клиническая проблема, которая нередко становится причиной острой сердечной недостаточности и смерти больного. Смертность при ТЭЛА достигает 30%, однако адекватная тактика ведения пациента с точной диагностикой и своевременным назначением оптимального лечения позволяет снизить этот показатель до 2-8%. Ситуация осложняется тем, что ТЭЛА далеко не всегда можно легко заподозрить и подтвердить, надежные диагностические методы требуют времени и финансовых затрат, в то время как тромбоэмболия во многих случаях развивается стремительно и ведет к жизнеугрожающему состоянию. Поэтому ТЭЛА нередко становится причиной смерти многих сердечно-сосудистых больных, а также пациентов некардиологического профиля (особенно перенесших операции, травмы, роды). Примерно у 10% больных ТЭЛА развивается молниеносно и приводит к гибели в течение часа после появления первых симптомов. Большинство этих фатальных случаев остаются нераспознанными и диагностируются только на аутопсии. Распространенность ТЭЛА у умерших пациентов в больницах составляет примерно 12-15% по данным аутопсий, и этот показатель остается стабильным на протяжении, по крайней мере, последних четырех десятилетий. При этом своевременное лечение ТЭЛА способно оказать очень высокий эффект. Именно поэтому более чем 90% больных, умерших от ТЭЛА, относятся к тем, у кого попросту не был установлен правильный диагноз и, соответственно, кому не было назначено адекватное лечение. ТЭЛА, как и в предыдущей версии руководства, рассматривается в тесной связи с тромбозом глубоких вен нижних конечностей – эти два заболевания в настоящее время все чаще расцениваются как проявления единого патологического процесса, который принято называть синдромом венозного тромбоэмболизма. Это связано с тем, что в 70-90% случаев причиной ТЭЛА является тромбоз глубоких вен, и наоборот – у половины пациентов с тромбозом глубоких вен нижних конечностей имеются тромбоэмболические поражения легочных сосудов (чаще асимптомные). Значительно реже источниками тромбов для малого круга кровообращения становятся верхняя полая вена и ее притоки, а также полости правых отделов сердца; такие тромбоэмболии чаще носят ятрогенный характер и обычно обусловлены тромбозом вен после инвазивных процедур (особенно часто источником тромбоза и эмболий из системы верхней полой вены становятся подключичные катетеры у тяжелых больных и постоянные венозные катетеры для проведения химиотерапии). Факторы риска венозного тромбоэмболизма, и ТЭЛА в частности, многообразны: пожилой возраст, длительная обездвиженность (вследствие пареза конечностей, после травм, в послеоперационном периоде, при частых и продолжительных перелетах в самолетах или поездках в автомобилях и т.д.), онкологические заболевания, травмы (особенно переломы крупных костей), хирургические вмешательства и внутрисосудистые инвазивные манипуляции (подключичный катетер и др.), прием некоторых лекарственных препаратов (заместительная гормональная терапия, использование оральных контрацептивов, химиотерапия), хроническая сердечная или дыхательная недостаточность, беременность и послеродовый период, тромбофилия. Имеются данные о том, что ТЭЛА ассоциируется также с такими проблемами, как ожирение, метаболический синдром, артериальная гипертензия, курение, сердечно-сосудистые события (инфаркт миокарда, инсульт). Так, тромбоэмболические осложнения, по данным разных авторов, встречаются у 30-60% больных с инсультами, обусловившими паралич нижних конечностей, у 5-35% пациентов после перенесенного инфаркта миокарда, более чем у 12% лиц с застойной сердечной недостаточностью. Разумеется, серьезным фактором риска является наличие заболеваний вен нижних конечностей в анамнезе, особенно тромбоз глубоких вен. Большинство из этих факторов риска являются потенциально модифицируемыми, в связи с чем прогнозирование риска ТЭЛА и ее первичная и вторичная профилактика представляются актуальными и выполнимыми задачами. Особое значение имеет профилактика ТЭЛА у пожилых людей: средний возраст лиц, пострадавших от этого заболевания, составляет 62 года, при этом большинство (не менее 65%) больных находятся в возрасте 60 лет и старше; у больных старше 80 лет ТЭЛА встречается в 8 раз чаще, чем у лиц моложе 50 лет. Острая тромбоэмболия проявляется заметной симптоматикой только в том случае, когда окклюзия охватывает более 30-50% легочного артериального русла. Клиника определяется гемодинамическими нарушениями; дыхательная недостаточность и гипоксия вторичны по отношению к изменениям сердечно-сосудистой системы. Крупные и/или множественные эмболы приводят к резкому возрастанию сосудистой резистентности легочного русла, в связи с чем значительно увеличивается преднагрузка на правые отделы сердца. Это может стать причиной внезапной смерти в результате остановки сердца. У других пациентов в такой ситуации могут развиться системная гипотензия, шок и смерть от острой правожелудочковой недостаточности. В случае адекватного срабатывания компенсаторных механизмов пациент не погибает сразу, однако при отсутствии лечения достаточно быстро нарастают вторичные гемодинамические нарушения, особенно при рецидивировании тромбоэмболий в ближайшие часы. Предсуществующие кардиоваскулярные заболевания существенно ухудшают компенсаторные возможности сердечно-сосудистой системы и ухудшают прогноз пациента. Кроме того, у многих пациентов происходит шунтирование крови справа налево через открытое овальное окно, в связи с чем усугубляется гипоксемия, возрастает риск парадоксальной эмболизации большого круга кровообращения и развития инсульта. В более легких случаях (мелкие эмболы, поражающие преимущественно небольшие дистальные сосуды) гемодинамические изменения мало выражены, а клинические проявления включают главным образом кровохарканье, плеврит и другие симптомы, которые известны как признаки «инфаркта легкого». Диагностика и стратификация риска при ТЭЛА Быстрая и корректная диагностика ТЭЛА является краеугольным камнем ведения этой патологии, поскольку чем раньше установлен диагноз, тем более эффективным может быть лечение. В связи с этим авторы обновленных рекомендаций пересмотрели подходы к диагностической оценке ТЭЛА и определению тяжести заболевания (степени риска) на основе полученных данных. До недавних пор было принято подразделять ТЭЛА на массивную, субмассивную и немассивную. Массивной ТЭЛА считалась, когда она приводила к обструкции более 50% объема сосудистого русла легких и проявлялась главным образом симптомами шока или системной гипотензии. Субмассивная ТЭЛА диагностировалась при обструкции значительного объема сосудистого русла легких, но менее 50%, и проявлялась симптомами правожелудочковой недостаточности. Немассивная ТЭЛА имела место при обструкции мелких, преимущественно дистальных ветвей; в клинической картине гемодинамика стабильна, признаков правожелудочковой недостаточности нет, симптоматика указывает на инфаркт легкого. В руководстве ESC от 2000 г. [2] предлагалось использовать именно эти термины. Под массивной ТЭЛА подразумевалось поражение, обусловливающее шок и/или системную гипотензию (снижение систолического артериального давления (АД) <90 мм рт. ст. или падение АД на ≥40 мм рт. ст. в течение не менее чем 15 мин, вне связи с аритмией, гиповолемией или сепсисом). В других случаях устанавливался диагноз немассивной ТЭЛА, а для подгруппы с немассивной тромбоэмболией, но с признаками гипокинезии правого желудочка (ПЖ) по данным эхокардиографии (ЭхоКГ) рабочая группа предлагала использовать термин «субмассивная ТЭЛА» [2]. В новом руководстве [1] термины «массивная», «субмассивная» и «немассивная ТЭЛА» признаны «вводящими в заблуждение», некорректными. Авторы документа предлагают использовать стратификацию больных на группы высокого и невысокого риска, а среди последних выделять подгруппы умеренного и низкого риска (таблица). Высоким риском считается риск ранней смерти (смерти в стационаре или в течение 30 суток после ТЭЛА), превышающий 15%; умеренным – до 15%; низким – менее 1%. Для определения риска ESC рекомендует ориентироваться на три группы маркеров – клинические маркеры, маркеры дисфункции ПЖ и маркеры повреждения миокарда (таблица 1).
Таким образом, уже при быстром обследовании у постели больного можно определить, относится пациент к группе высокого риска ранней смерти или нет. При дальнейшем обследовании тех, у кого нет клинических признаков высокого риска (шока, гипотензии), можно оценить риск более точно. Такой подход позволяет в максимально ранние сроки определиться с тактикой ведения больных и своевременно назначить жизнеспасающее лечение больным наивысшего риска. Этот подход оправдан в связи с тем, что в 90% случаев диагноз ТЭЛА с большой вероятностью дальнейшего подтверждения можно заподозрить только по клиническим признакам. Такие симптомы, как внезапная одышка, тахипноэ, боль в грудной клетке, обморок, хотя и являются неспецифичными, однако они имеют место практически у всех больных с ТЭЛА, и, сопоставив их с имеющимися факторами риска (иммобилизация, послеоперационный период, наличие венозных катетеров и др.), врач редко ошибется, заподозрив тромбоэмболию. Однако следует помнить, что в значительной доле случаев ТЭЛА происходит вне связи с какими-либо предрасполагающими факторами (идиопатическая тромбоэмболия). Вместе с тем, ни клинические признаки, ни стандартные методы обследования (обычные лабораторные тесты, электрокардиография, рентгенография органов грудной клетки) не дают возможности ни подтвердить, ни исключить диагноз ТЭЛА. К чувствительным и специфичным методам диагностики этой патологии относятся определение D-димера, ЭхоКГ, компьютерная томография (КТ), вентиляционно-перфузионная сцинтиграфия, ангиография, а также методы диагностики тромбоза глубоких вен нижних конечностей (ультрасонография, КТ-венография). Новое руководство ESC предлагает следующий алгоритм обследования пациентов с подозрением на ТЭЛА высокого риска. 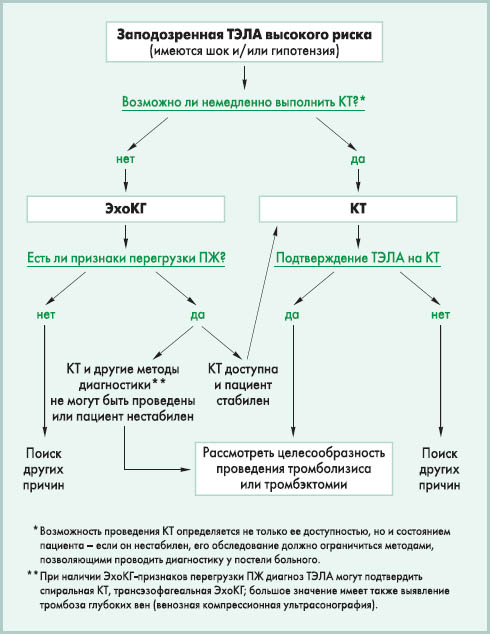 Для обследования пациентов с подозрением на ТЭЛА невысокого риска рекомендуется другой алгоритм. 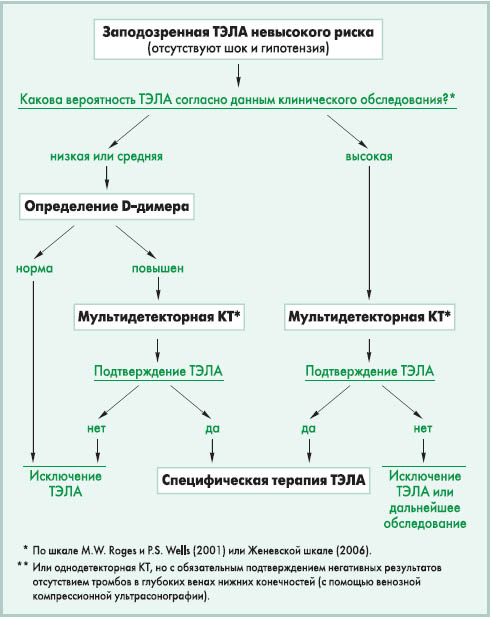 Таким образом, алгоритм диагностики ТЭЛА основан преимущественно на использовании КТ (чувствительного, неинвазивного и относительно доступного метода обследования), однакопредварительно необходимо исключить пациентов, которым КТ не потребуется (для больных высокого риска – с помощью ЭхоКГ, для больных невысокого риска – с помощью оценки вероятности ТЭЛА и определения уровня D-димера). В общих чертах этот алгоритм разделяется на ступеньки, каждая из которых позволяет четко и быстро сортировать пациентов, избегать у большинства ненужных и дорогостоящих методов обследования, а для тех, кто нуждается в немедленной помощи, точно и достоверно устанавливать диагноз ТЭЛА. КТ на сегодняшний день признана экспертами ESC наиболее приемлемым методом подтверждения наличия тромба в легочных сосудах, рекомендованным для рутинной клинической практики. У больных высокого риска достаточно обычной (однодетекторной) КТ, чтобы подтвердить или исключить ТЭЛА (I, C), однако у больных невысокого риска рекомендуется использовать мультидетекторную КТ – она позволяет более четко визуализировать сегментарные и субсегментарные ветви легочной артерии и достоверно подтвердить или исключить ТЭЛА (I, A). Если мультидетекторную КТ нет возможности использовать, у таких пациентов либо устанавливается диагноз ТЭЛА при положительных результатах однодетекторной КТ (I, A), либо требуется двойной контроль для исключения ТЭЛА – негативные результаты однодетекторной КТ сопоставляются с данными венозной компрессионной ультрасонографии, и если оба метода обследования не обнаружат тромбов, только тогда диагноз ТЭЛА можно снять (I, A). Из представленных алгоритмов видно, что ЭхоКГ предпочтительна как один из первоочередных методов диагностики для пациентов высокого риска. Как и уровень D-димера у больных невысокого риска, ЭхоКГ выполняет роль «сортировочного» метода обследования: она не дает возможности подтвердить диагноз ТЭЛА, однако достоверно позволяет исключить ее и своевременно направить диагностический поиск в другом направлении. Однако у нестабильных пациентов высокого риска, которым невозможно подтвердить диагноз такими методами обследования, как КТ или вентиляционно-перфузионная сцинтиграфия, положительные результаты ЭхоКГ могут расцениваться как непрямое доказательство ТЭЛА и позволяют немедленно начать специфическое лечение (I, C); но после стабилизации пациента следует все же дообследовать его для окончательного подтверждения диагноза. У больных невысокого риска ЭхоКГ также широко используется: она играет важную роль в дифференциальной диагностике и стратификации риска. Исследование дает возможность обнаружить признаки перегрузки правых отделов сердца, обнаружить возможную патологию клапанов или миокарда, иногда – визуализировать тромб в полости сердца. Однако рутинное использование ЭхоКГ у гемодинамически стабильных, нормотензивных пациентов невысокого риска руководством не рекомендуется (III, C). Если это возможно, у некоторых больных рекомендуется проведение трансэзофагеальной ЭхоКГ, которая позволяет непосредственно визуализировать тромбы в легочных сосудах. У пациентов невысокого риска алгоритм обследования требует двух простых «сортировочных ступенек» перед КТ – предварительной оценки вероятности ТЭЛА по клиническим признакам (I, A) и определения уровня D-димера у тех, для кого вероятность ТЭЛА определена как низкая или средняя. Вероятность ТЭЛА предварительно можно оценить по шкале M.W. Roges и P.S. Wells (2001): – клинические симптомы тромбоза глубоких вен нижних конечностей – 3 балла; – при проведении дифференциального диагноза ТЭЛА более вероятна, чем другие патологии, – 3 балла; – тахикардия >100 уд/мин – 1,5 балла; – иммобилизация или хирургическое вмешательство на протяжении последних 3 дней – 1,5 балла; – тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе – 1,5 балла; – кровохарканье – 1 балл; – онкологическая патология в настоящее время или давностью до 6 мес – 1 балл. Если сумма не превышает 2 баллов, вероятность ТЭЛА низкая; при сумме баллов 2-6 – умеренная; более 6 баллов – высокая. Кроме того, в последние годы в Европе нередко используется так называемая Женевская шкала (G. le Gal et al., 2006): – тахикардия ≥95 уд/мин – 5 баллов; – тахикардия 75-94 уд/мин – 3 балла; – клинические признаки тромбоза глубоких вен нижних конечностей (боль при пальпации вены + отек одной конечности) – 4 балла; – подозрение на тромбоз глубоких вен нижних конечностей (боль в одной конечности) – 3 балла; – подтвержденные тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе – 3 балла; – хирургическое вмешательство или перелом на протяжении последнего месяца – 2 балла; – кровохарканье – 2 балла; – онкологическая патология – 2 балла; – возраст >65 лет – 1 балл. Если сумма не превышает 3 баллов, вероятность ТЭЛА низкая; при сумме баллов 4-10 – умеренная; ≥11 баллов – высокая. У больных невысокого риска с низкой или средней вероятностью ТЭЛА показано определение в крови уровня D-димера. Этот метод обследования имеет высокую отрицательную диагностическую ценность, то есть позволяет достоверно исключить у пациента ТЭЛА при нормальном содержании D-димера (<500 мкг/л) (I, A). Однако повышенный уровень D-димера неспецифичен для ТЭЛА (может быть обусловлен и другими причинами – различными заболеваниями, беременностью и т.д.), поэтому положительная диагностическая ценность этого метода невысока (III, C), и в этом случае больному требуется дообследование для подтверждения наличия тромба в легочных сосудах. Несмотря на это, такой алгоритм позволяет на этом этапе исключить ТЭЛА без дальнейшего обследования у трети больных, поэтому определение D-димера имеет большое значение для сортировки пациентов с подозрением на тромбоэмболию. Таким образом, в новом руководстве ESC (2008) [1] предлагается четкий и простой алгоритм, не требующий высоких затрат, не отнимающий много времени и представляющийся доступным для большинства клиник, в том числе некардиологического профиля. Основные «действующие лица» при этом – клиническая картина, ЭхоКГ у постели больного, определение уровня D-димера и КТ. Другие методы обследования имеют вспомогательное значение. Вентиляционно-перфузионная сцинтиграфия – достаточно чувствительный метод диагностики, который используется преимущественно в тех случаях, когда противопоказана КТ. При негативных результатах сцинтиграфии у пациентов с низкой вероятностью ТЭЛА можно исключить диагноз тромбоэмболии (I, A). Положительные результаты сканирования у пациентов с высокой вероятностью ТЭЛА подтверждают диагноз, но у пациентов с низкой вероятностью ТЭЛА для уточнения диагноза могут потребоваться дополнительные методы обследования (IIb, B). Венозная компрессионная ультрасонография позволяет обнаружить тромбоз глубоких вен нижних конечностей и тем самым подтвердить ТЭЛА в случае ложнонегативных результатов, которые могут быть получены при однодетекторной КТ. Этот метод обследования показан также в тех случаях, когда пациентам не может быть проведена КТ, ангиография или другие методы визуализации тромба в легочных артериях, – характерная клиника ТЭЛА в сочетании с подтвержденным источником тромбов в проксимальных отделах глубоких вен нижних конечностей позволяет диагностировать ТЭЛА (I, B). Однако наличие тромбов в дистальных отделах глубоких вен нижних конечностей требует дополнительных методов обследования для подтверждения диагноза ТЭЛА (IIa, B). Значение этого метода обследования и показания к нему продолжают обсуждаться, отмечается в руководстве. Ангиография легочных сосудов достаточно точно позволяет диагностировать ТЭЛА, однако это инвазивный метод обследования, который не имеет преимуществ перед КТ. Использование ангиографии может быть полезным, если результаты неинвазивных методов обследования оказались противоречивыми (IIa, C). Однако у больных высокого риска ангиография не рекомендуется, поскольку она повышает риск смерти у нестабильных пациентов и увеличивает риск кровотечений после тромболитической терапии. Лечение ТЭЛА Основными направлениями лечения ТЭЛА являются гемодинамическая и респираторная поддержка, реперфузия (тромболизис или хирургическое удаление эмболов из легочных артерий), антикоагулянтная терапия. При этом стратегия лечения существенно зависит от степени риска.
Лечение ТЭЛА у пациентов высокого риска 1. Немедленно должна быть начата антикоагулянтная терапия нефракционированным гепарином (I, A). 2. Для профилактики дальнейшего прогрессирования правожелудочковой недостаточности необходимо устранить системную гипотензию. С этой целью рекомендуются вазопрессивные препараты (I, C). У пациентов с низким сердечным выбросом и нормальным АД могут быть использованы добутамин и допамин (IIa, B). 3. Не рекомендована агрессивная инфузионная терапия (III, B). 4. Пациентам с гипоксемией необходимо проведение оксигенотерапии (I, C). 5. У пациентов высокого риска с ТЭЛА, сопровождающейся кардиогенным шоком и/или артериальной гипотензией, показана тромболитическая терапия (I, A). 6. Если тромболизис абсолютно противопоказан или оказался неэффективным, альтернативным методом реперфузии является хирургическая эмболэктомия (I, C). 7. Если тромболизис абсолютно противопоказан или оказался неэффективным, в качестве альтернативного метода реперфузии может рассматриваться также чрескожная катетерная эмболэктомия или фрагментация тромба (IIb, C).
Лечение ТЭЛА у пациентов невысокого (умеренного или низкого) риска 1. Антикоагулянтная терапия должна быть начата немедленно у пациентов с высокой или средней вероятностью ТЭЛА еще в процессе диагностики, не дожидаясь окончательного подтверждения диагноза (I, С). Для большинства пациентов в качестве предпочтительного антикоагулянта рекомендуется препарат группы низкомолекулярных гепаринов или фондапаринукс (I, A), однако у больных с высоким риском геморрагических осложнений, а также в случае наличия тяжелой почечной дисфункции для стартовой антикоагулянтной терапии показан нефракционированный гепарин с удержанием активированного частичного тромбопластинового времени (АЧТВ) в пределах значений, в 1,5-2,5 раза превышающих нормальный показатель (I, С). Антикоагулянтная терапия нефракционированным гепарином, низкомолекулярным гепарином или фондапаринуксом должна продолжаться не менее 5 дней и может быть заменена на антагонист витамина К только после достижения целевого международного нормализованного отношения (МНО) и удержания его на протяжении как минимум 2 дней (I, С). 2. Рутинное использование тромболитической терапии у больных невысокого риска не рекомендовано, но ее целесообразность может быть рассмотрена у некоторых пациентов с умеренным риском (IIb, B). Тромболитическая терапия не показана у пациентов с низким риском (III, B). Следует остановиться подробнее на ключевых аспектах лечения ТЭЛА – тромболитической и антикоагулянтной терапии, а также на хирургических методах реперфузии.
Реперфузионное лечение Тромболитическая терапия при ТЭЛА долгое время являлась предметом обсуждения специалистов. Многие ученые считают, что проведение тромболизиса оправдано не только при ТЭЛА высокого риска, но и в более легких случаях. Тем не менее, с 2000 г. в руководстве ESC положение относительно показаний к тромболизису при ТЭЛА существенно не изменилось. Обновленные в 2008 г. рекомендации декларируют, что тромболитическая терапия является методом выбора для лечения больных высокого риска, может использоваться у некоторых больных умеренного риска и не показана у больных низкого риска. В настоящее время проблемной остается категория больных умеренного риска – неизвестно, показана ли им тромболитическая терапия, как пациентам группы высокого риска, или же лечение, основанное на антикоагуляции, как в группе низкого риска. Доказательные данные в этом отношении противоречивы, и эксперты пока не могут сделать определенных выводов, только отмечают, что, вероятно, у отдельных пациентов тромболизис может быть целесообразным, хотя не могут сформулировать критериев отбора пациентов, подходящих для проведения реперфузии. В исследовании S. Konstantinides et al. (2002) у пациентов с ТЭЛА и умеренным риском смерти сравнивались тромболизис (rtPA) и гепаринотерапия. Частота комбинированной первичной конечной точки (внутригоспитальная смерть или клиническое ухудшение, требующее интенсификации терапии) значительно уменьшилась в группе тромболизиса по сравнению с лечением гепарином, хотя достоверных различий между группами по общей смертности не было отмечено. По результатам этого исследования был сделан вывод, что тромболитическая терапия у больных умеренного риска может быть предпочтительной перед стратегией лечения, основанной на антикоагуляции, особенно у пациентов с низким риском геморрагических осложнений. В начале 2008 г. было начато проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование PEITHO (Pulmonary Embolism International Thrombolysis Study), благодаря которому, возможно, вопрос о необходимости тромболизиса у этой категории больных ТЭЛА будет решен окончательно. На этот момент в PEITHO набраны пациенты из 6 стран Европы – Франции, Италии, Германии, Польши, Швейцарии и Словении; в ближайшее время к ним присоединятся еще шесть стран. В целом планируется до конца 2010 г. набрать тысячу пациентов; это будет крупнейшее на сегодняшний день исследование, посвященное тромболитической терапии при ТЭЛА. Однако пока тромболитическую терапию можно уверенно рекомендовать только больным высокого риска. Наибольшие преимущества от тромболизиса получают пациенты, которым реперфузия была проведена в первые 48 ч после начала ТЭЛА, однако тромболитическая терапия может быть успешной и у тех больных, у которых первые симптомы ТЭЛА появились 6-14 дней назад. Для тромболитической терапии при ТЭЛА на сегодняшний день одобрено три режима: 1. Стрептокиназа: а) обычная схема – нагрузочная доза 250 тыс. МЕ (на протяжении 30 мин), далее 100 тыс. МЕ в час на протяжении 12-24 ч; б) ускоренная схема – 1,5 млн МЕ на протяжении 2 ч. 2. Урокиназа: а) обычная схема – нагрузочная доза 4400 МЕ/кг массы тела (на протяжении 10 мин), далее 4400 МЕ/кг массы тела в час на протяжении 12-24 ч; б) ускоренная схема – 3 млн МЕ на протяжении 2 ч; 3. rtPA (альтеплаза): а) 100 мг на протяжении 2 ч; б) ускоренная схема – 0,6 мг/кг массы тела на протяжении 15 мин (максимальная доза 50 мг). Кроме того, имеются предварительные доказательные данные о потенциальной возможности применения с этой целью ретеплазы и тенектеплазы, однако эти препараты еще предстоит подробнее изучить в достаточно крупных рандомизированных исследованиях, чтобы сделать определенные выводы об их преимуществах и предпочтительных режимах назначения. Следует отметить, что системный тромболизис предпочтительнее селективного – последний не показал своих преимуществ перед системным, однако сопровождается повышенным риском геморрагических осложнений из места введения катетера. По данным N. Meneveau et al. (2006) около 92% пациентов отвечают на тромболизис клиническим и эхографическим улучшением на протяжении 36 ч. Однако в целом клинические исходы после тромболизиса на сегодняшний день сложно оценить, поскольку в большинстве исследований, изучавших эту стратегию лечения при ТЭЛА, не определялись конечные точки. Риск геморрагических осложнений при тромболитической терапии ТЭЛА зависит от сопутствующей патологии и в среднем (по совокупным данным целого ряда исследований) достигает 13% для серьезных геморрагий в целом и 1,8% для внутричерепных и/или фатальных геморрагий. Хотя в некоторых исследованиях (S.Z. Goldhaber et al., 1993; S. Konstantinides et al., 2002) он был ниже, что, вероятно, объясняется использованием неинвазивных методов обследования. При этом авторы руководства [1] отмечают, что следует учитывать общий риск смерти: у пациентов высокого риска с ТЭЛА даже те состояния, которые при инфаркте миокарда считаются абсолютными противопоказаниями к тромболизису (например, проведенное в предыдущие 3 нед хирургическое вмешательство или перенесенное в предыдущий месяц желудочно-кишечное кровотечение), при ТЭЛА могут быть расценены как относительные противопоказания и не вынуждают отказываться от тромболитической терапии в жизнеугрожающих состояниях. Хирургическая эмболэктомия в настоящее время может рассматриваться как альтернативный метод лечения ТЭЛА у больных высокого риска. На протяжении длительного времени этот подход использовался при ТЭЛА очень редко, однако в последние годы хирургическая техника значительно усовершенствовалась, появились убедительные доказательные данные по эффективности и безопасности такой операции. Для центров, в которых хирургическая эмболэктомия проводится рутинно у большого количества больных, эта операция, как правило, не представляет больших сложностей. Если исключить больных, находящихся в состоянии тяжелого шока, ранняя смертность после этого вмешательства не должна превышать 6-8%. Еще одним альтернативным методом реперфузии может быть чрескожная эмболэктомия с помощью катетера или фрагментация тромба. Доказательная база по этим вмешательствам на сегодняшний день ограничена, однако есть свидетельства тому, что в некоторых случаях такие операции могут иметь жизнеспасающее значение при крупных эмболах легочного ствола или главных легочных артерий.
Антикоагуляция Наряду с реперфузией, центральную роль в лечении ТЭЛА играет антикоагулянтная терапия. Еще в 1960 г. D.W. Barrit и S.C. Jordan показали существенные преимущества использования нефракционированного гепарина при ТЭЛА. Своевременная и активная антикоагуляция значительно уменьшает риск смерти и рецидивов тромбоэмболий и потому рекомендуется не только у лиц, для которых диагноз тромбоэмболии подтвержден, но и при достаточно высокой вероятности ТЭЛА еще в процессе диагностики. Со времени публикации руководства 2000 г. [2] в этой области произошли существенные изменения – упрочилась доказательная база для низкомолекулярных гепаринов и варфарина, появился новый антикоагулянтный препарат фондапаринукс, подтвердивший свою эффективность и безопасность, сравнимые с таковыми у нефракционированного и низкомолекулярных гепаринов. На сегодняшний день для стартовой антикоагуляции при ТЭЛА одобрено использование нефракционированного гепарина (внутривенно), низкомолекулярных гепаринов (подкожно) и фондапаринукса (подкожно). Режим введения нефракционированного гепарина зависит от уровня АЧТВ – дозу препарата следует корректировать таким образом, чтобы АЧТВ превышало контрольные показатели в 1,5-2,5 раза. Но при этом авторы руководства [1] отмечают, что уровень АЧТВ отнюдь не является идеальным критерием для оценки адекватности режима введения гепарина. В большинстве случаев вместо нефракционированного гепарина могут использоваться низкомолекулярные гепарины, которые удобнее в применении и не требуют контроля АЧТВ, однако эти препараты следует назначать с осторожностью при почечной дисфункции (в случае уменьшения клиренса креатинина <30 мл/мин предпочтителен нефракционированный гепарин), а также при высоком риске геморрагических осложнений (нефракционированный гепарин имеет более короткую длительность действия и потому его быстрее можно отменить в случае развития кровотечения). В метаанализе D.J. Quinlan et al. (2004), объединившем данные нескольких рандомизированных контролированных исследований, в которых сравнивались нефракционированный гепарин и низкомолекулярные гепарины при ТЭЛА, было показано, что обе схемы лечения одинаково эффективны и безопасны – не было обнаружено достоверных различий по уровню рецидивов тромбоэмболий, серьезных геморрагических осложнений и по смертности от всех причин. Для лечения ТЭЛА рекомендованы такие низкомолекулярные гепарины, как эноксапарин (10 мг/кг массы тела каждые 12 ч или 1,5 мг/кг 1 раз в сутки; последний режим одобрен в США и некоторых европейских странах, хотя и не во всех) и тинзапарин (175 ЕД/кг 1 раз в сутки). У больных с онкозаболеваниями в случае венозного тромбоэмболизма (тромбоза глубоких вен и/или ТЭЛА) может использоваться также дальтепарин (200 ЕД/кг 1 раз в сутки). Иногда используются и другие низкомолекулярные гепарины, хотя для них на сегодняшний день пока ограничена доказательная база по применению у больных с ТЭЛА. Однако низкомолекулярные гепарины пока не могут быть рекомендованы у больных высокого риска с гемодинамической нестабильностью, поскольку во всех рандомизированных исследованиях, изучавших применение этих препаратов при ТЭЛА, больные высокого риска исключались. При назначении как нефракционированного гепарина, так и низкомолекулярных гепаринов необходимо контролировать уровень тромбоцитов в крови, учитывая риск развития гепарининдуцированной тромбоцитопении. Кроме того, для антикоагуляции при ТЭЛА рекомендуется назначение селективного ингибитора фактора Xa – фондапаринукса. Препарат назначается подкожно 1 раз в сутки в трех режимах дозировок в зависимости от массы тела пациента: 5 мг (<50 кг), 7,5 мг (50-100 кг) или 10 мг (>100 кг). В исследовании H.R. Buller et al. (2003) фондапаринукс подтвердил свою высокую эффективность при ТЭЛА – при его применении количество рецидивов тромбоэмболий и серьезных геморрагических осложнений было сравнимым с таковым на фоне приема нефракционированного гепарина. Кроме того, фондапаринукс не вызывает тромбоцитопению, в связи с чем при его введении не нужно контролировать уровень тромбоцитов в крови. Однако фондапаринукс противопоказан при тяжелой почечной недостаточности (клиренс креатинина <20 мл/мин). Как можно раньше также следует назначить перорально антагонист витамина К (варфарин) – желательно в тот же день, когда стартовало парентеральное введение антикоагулянтов прямого действия. Рекомендуется использовать начальные дозы варфарина 5 или 7,5 мг, хотя у пациентов моложе 60 лет и без серьезной сопутствующей патологии безопасной является начальная доза 10 мг. После достижения МНО в пределах 2,0-3,0 и удержания его на таком уровне не менее чем 2 суток прямые антикоагулянты можно отменить (но не ранее, чем через 5 сут после начала их применения). Вторичная профилактика Пациентам, перенесшим ТЭЛА, рекомендуется лечение антагонистом витамина К на протяжении 3 мес, если тромбоэмболия была спровоцирована модифицируемым (преходящим) фактором, и не менее 3 мес, если тромбоэмболия была спонтанной (I, A). У пациентов с первым эпизодом тромбоэмболии, не спровоцированной какими-либо первичными факторами, и с низким риском кровотечений может быть рассмотрена целесообразность долгосрочного приема пероральных антикоагулянтов (IIb, B); в случае повторного эпизода неспровоцированной тромбоэмболии долгосрочная антикоагулянтная терапия является рекомендуемой (I, A). Польза/риск долгосрочной антикоагулянтной терапии должны регулярно оцениваться через равные промежутки времени (I, C). Вне зависимости от длительности антикоагулянтной терапии после перенесенной ТЭЛА при лечении антагонистом витамина К рекомендуется поддерживать уровень МНО в пределах 2,0-3,0 (I, A). У пациентов, страдающих онкопатологией и перенесших ТЭЛА, следует рассмотреть целесообразность применения низкомолекулярных гепаринов на протяжении первых 3-6 мес (IIa, B); по истечении этого срока необходимо продолжить антикоагулянтную терапию антагонистом витамина К или низкомолекулярным гепарином вне зависимости от того, курабельно злокачественное заболевание или нет (I, C). Вопрос относительно необходимости установки кава-фильтров для профилактики рецидивов тромбоэмболий на сегодняшний день не решен. В руководстве 2008 г. [1] указывается, что рутинное использование внутривенных фильтров у пациентов, перенесших ТЭЛА, на сегодняшний день не рекомендовано (III, B), однако они могут использоваться в тех случаях, когда у пациента высокий риск рецидива тромбоэмболии и имеются абсолютные противопоказания к антикоагулянтной терапии (IIb, B). Постоянные кава-фильтры способны обеспечить пожизненную защиту от рецидива ТЭЛА, если источником тромбов являются глубокие вены нижних конечностей или вены малого таза. Однако осложнения, связанные с наличием таких фильтров, не являются редкостью. Уже у 10% пациентов развиваются ранние осложнения, поздние осложнения встречаются гораздо чаще. В течение 5 лет после установки кава-фильтра у 22% пациентов вне зависимости от характера и длительности антикоагулянтной терапии развивается окклюзия нижней полой вены; в течение 9 лет – у 33%. Однако точно определить соотношение польза/риск при использовании кава-фильтров на сегодняшний день сложно в связи с ограниченным количеством доказательных данных, касающихся этого вопроса. Особенности ведения больных в некоторых специфических клинических ситуациях
Беременность и роды ТЭЛА на фоне беременности встречается в 0,3-1 случае на 1000 рожениц и в развитых странах представляет собой ведущую причину материнской смертности (E.A. Sullivan et al., 2004). Риск ТЭЛА выше всего в послеродовом периоде, особенно после кесарева сечения. Диагностический алгоритм при ТЭЛА у беременных не отличается существенно, даже учитывая необходимость ограничить воздействие ионизирующего излучения на плод. Нормальный уровень D-димера позволяет исключить диагноз ТЭЛА. Диагноз может считаться установленным, если имеются повышенный уровень D-димера и обнаружены тромбы в глубоких венах нижних конечностей, однако при отрицательных результатах компрессионной венозной ультрасонографии необходимо прибегнуть к другим методам обследования. Предпочтительными при этом являются КТ и вентиляционно-перфузионная сцинтиграфия, в то время как ангиография должна использоваться только в сомнительных случаях, учитывая инвазивность метода и высокий уровень радиационной нагрузки. При подтвержденной ТЭЛА рекомендуется назначение низкомолекулярных гепаринов, в то время как антагонисты витамина К не показаны на протяжении первого и третьего триместров беременности и могут использоваться с осторожностью во время второго триместра. Применение варфарина в первом триместре беременности ассоциировано с эмбриопатиями, в третьем – с геморрагическими осложнениями у плода и новорожденного, а также с отслойкой плаценты. После родов варфарин может быть назначен вместо препарата группы низкомолекулярных гепаринов и безопасно использоваться даже у кормящих матерей. Доказательных данных по применению фондапаринукса у беременных на сегодняшний день нет. Антикоагуляция должна продолжаться до конца беременности и не менее чем 3 мес после родов.
Злокачественные заболевания Хотя онкопатология является важным предрасполагающим фактором для развития тромбоэмболических осложнений, рутинный скрининг на злокачественные заболевания у всех больных с неспровоцированным первым эпизодом ТЭЛА не рекомендуется. Подтвержденная ТЭЛА у онкобольных требует назначения антикоагулянтной терапии, вне зависимости от того, является новообразование курабельным или нет.
Тромб в полостях правых отделов сердца Тромб в полостях правых отделов сердца встречается примерно у 4% больных с ТЭЛА и ассоциируется с более высокими уровнями ранней смертности. Его наличие требует немедленного лечения, при этом предпочтительными методами являются тромболизис и эмболэктомия. Длительная антикоагулянтная терапия в этом случае менее эффективна. При отсутствии лечения смертность при наличии мобильного тромба в правых отделах сердца составляет 80-100%.
Хроническая посттромбоэмболическая легочная гипертензия Хроническая посттромбоэмболическая легочная гипертензия обнаруживаетсяу 0,5-5% пациентов, получавших лечение по поводу ТЭЛА. Это редкое, но достаточно тяжелое осложнение ТЭЛА. Хроническая посттромбоэмболическая легочная гипертензия практически не поддается консервативному лечению, однако эмболэктомия обеспечивает хорошие результаты и может быть рекомендована как метод выбора.
Нетромботическая эмболия легочной артерии Нетромботические легочные эмболы встречаются довольно редко, и механизмы их развития существенно отличаются от ТЭЛА. Соответственно, имеются отличия и в характере течения, клинических проявлениях, подходах к лечению таких эмболий. В руководстве вкратце описываются основные причины таких эмболий и указываются их отличия от классической тромботической эмболии. Лечение в таких случаях зависит от вида эмболии и тяжести заболевания, однако в целом имеет симптоматический характер. Литература 1. Torbicki A., Perrier A., Konstantinides S. et al. Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). European Heart Journal 2008; 29 (18): 2276-2315. 2. Torbicki A., van Beek E. J. R., Charbonnier B. et al. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force on Pulmonary Embolism, European Society of Cardiology. European Heart Journal 2000; 21: 1301-1336. 3. Snow V., Qaseem A., Barry P. et al. and the Joint American Academy of Family Physicians/American College of Physicians Panel on Deep Venous Thrombosis/Pulmonary Embolism. Management of Venous Thromboembolism: A Clinical Practice Guideline from the American College of Physicians and the American Academy of Family Physicians. Annals of Internal Medicine 2007; 146 (3): 204-210. 4. Segal J.B., Eng J., Tamariz L.J., Bass E.B. Review of the evidence on diagnosis of deep venous thrombosis and pulmonary embolism. Ann Fam Med 2007; 5: 63-73. 5. Segal J.B., Streiff M.B., Hoffman L.V. et al. Management of venous thromboembolism: a systematic review for a practice guideline. Ann Intern Med 2007; 146: 211-22. 6. Roy P.M., Colombet I., Durieux P. et al. Systematic review and metaanalysis of strategies for the diagnosis of suspected pulmonary embolism. BMJ 2005; 331: 259. 7. Tapson V.F. Acute Pulmonary Embolism. New England Journal of Medicine 2008; 358: 1037-1052. Автор обзора Анна Карташева Medicine Review 2008; 4 (04): 56-64 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |