Порівняння раннього переходу на монотерапію тикагрелором зі стандартною ПАТ після ЧКВ у пацієнтів із ГКС: результати дослідження ULTIMATE-DAPTПопри досягнуті за останні роки успіхи в профілактиці й лікуванні, серцево-судинні (СС) захворювання залишаються основною причиною смертності в усьому світі, а ішемічна хвороба серця (ІХС) належить до основних захворювань, пов'язаних із виникненням медичних проблем у дорослих, старших за 25 років [1]. Водночас різні прояви ІХС по-різному впливають на прогноз пацієнтів, зокрема гострий коронарний синдром (ГКС) асоціюється з вищим ризиком смерті та інфаркту міокарда (ІМ) порівняно з хронічним коронарним синдромом (ХКС). Пов’язаний із ГКС несприятливий прогноз можна поліпшити за допомогою ранньої реваскуляризації міокарда [2, 3] з подальшою адекватною за потужністю і тривалістю антитромбоцитарною терапією. Зокрема, після черезшкірного коронарного втручання (ЧКВ) із приводу ГКС на сьогодні більшості пацієнтів рекомендують річну подвійну антиагрегантну терапію (ПАТ) ацетилсаліциловою кислотою (АСК) та інгібітором P2Y12-рецепторів тромбоцитів (іP2Y12), яка доведено знижує ризик ІМ і тромбозу стента [2, 3]. Згідно з міжнародними настановами, оптимальним іP2Y12 у такій ситуації є тикагрелор або прасугрель, які мають перевагу над клопідогрелем [4, 5], однак відомо, що у випадку з 12-місячною ПАТ перевага потужних іP2Y12 у профілактиці ішемічних подій досягається за рахунок зростання ризику геморагічних ускладнень, у тому числі потенційно небезпечних для життя кровотеч. У зв'язку із цим останніми роками триває активне вивчення ефектів стратегії раннього скасування АСК після ЧКВ за наявності ГКС або ХКС [4–15]. Проведений у 2023 році метааналіз 32 рандомізованих клінічних досліджень, присвячених вивченню різних підходів до зниження геморагічного ризику антиагрегантної терапії після ЧКВ, показав, що в пацієнтів із ГКС, що пройшли ЧКВ, перехід на монотерапію іP2Y12 після ≤6-місячної ПАТ був пов'язаний із найнижчим ризиком великої кровотечі й смерті від будь-яких причин [16]. Однак результати переходу на монотерапію іP2Y12 після ЧКВ і лише місячної ПАТ в умовах ГКС у дослідженнях, що ввійшли до зазначеного метааналізу, були вивчені недостатньо [16]. З огляду на ці обставини було організовано й проведено міжнародне дослідження ULTIMATE-DAPT – ініційоване дослідниками рандомізоване подвійне сліпе дослідження результатів переходу на монотерапію тикагрелором після 1 місяця ПАТ у пацієнтів, які перенесли ЧКВ із приводу ГКС і пройшли 1-місячний період ПАТ без розвитку несприятливих подій [17]. Мета дослідження полягала в тому, щоб оцінити, чи може така стратегія знизити частоту клінічно значущих кровотеч без супутнього збільшення ризику серйозних несприятливих СС або цереброваскулярних подій (MACCE) порівняно з продовженням стандартної ПАТ. Основна інформація про це дослідження стисло подана нижче.
Методологія дослідження ULTIMATE-DAPT Рандомізоване подвійне сліпе плацебо-контрольоване клінічне дослідження ULTIMATE-DAPT було частиною міжнародної програми IVUS-ACS + ULTIMATE-DAPT (порівняння результатів 1-місячної ПАТ із подальшою монотерапією тикагрелором та 12-місячної ПАТ після імплантації стентів із лікарським покриттям [СЛП], проведеної під контролем внутрішньосудинного ультразвукового дослідження [ВСУЗД] або ангіографії, в пацієнтів із ГКС). Ця дослідницька програма включала два інтегрованих рандомізованих дослідження, IVUS-ACS і ULTIMATE-DAPT, які проводили в 58 дослідницьких центрах у Китаї (n=52), Пакистані (n=4), Великій Британії (n=1) та Італії (n=1). У цій статті описуються основні характеристики й результати другої частини дослідження, присвяченої порівнянню ефектів раннього (через місяць ПАТ) переходу на монотерапію тикагрелором порівняно зі стандартною 12-місячною ПАТ (ULTIMATE-DAPT) [17]. У дослідженні брали участь пацієнти віком 18 років і старші, які перенесли ГКС (нестабільну стенокардію [НС], ІМ без підйому сегмента ST [ІМбпST] або ІМ із підйомом сегмента ST [ІМпST]), спричинений ураженням раніше нелікованого сегмента коронарної артерії, з показаннями до ЧКВ з імплантацією СЛП другого покоління, упродовж 30 днів до рандомізації. Критеріями виключення були: інсульт, перенесений за останні 3 місяці, або будь-який постійний неврологічний дефіцит, будь-яка раніше перенесена внутрішньочерепна кровотеча або захворювання внутрішньочерепних судин (наприклад, аневризма або свищ), аортокоронарне шунтування (АКШ) в анамнезі, будь-яка планова операція протягом останніх 12 місяців, будь-яка причина, яка може вимагати скасування антиагрегантної терапії протягом найближчих 12 місяців, тяжка хронічна хвороба нирок (розрахункова швидкість клубочкової фільтрації <20 мл/хв на 1,73 м2), показання до хронічної пероральної антикоагулянтної терапії (наприклад, варфарином, кумадином або прямими пероральними антикоагулянтами), кількість тромбоцитів менша ніж 100 000 мм3, протипоказання до призначення АСК або тикагрелору, цироз печінки, планування вагітності, очікувана тривалість життя менша за рік і будь-який стан, який міг перешкодити дослідницьким заходам, у тому числі дотриманню режиму приймання препаратів або виконанню візитів у періоді спостереження (наприклад, деменція, зловживання алкоголем, сильна слабкість або необхідність долати великі відстані для відвідування дослідницького центру) [17]. Пацієнти, які відповідали критеріям набору в дослідження, проходили ЧКВ під контролем ВСУЗД або ангіографії (за результатами першої рандомізації, що проводилася в рамках дослідження IVUS-ACS), а також розпочинали приймання ПАТ комбінацією тикагрелору в дозі 90 мг 2 рази на день і кишковорозчинної форми АСК у дозі 100 мг/добу, причому перші дози тикагрелору і АСК учасники приймали до проведення ЧКВ. Через місяць після ЧКВ усі учасники, які вижили, не мали великих кровотеч (кровотечі 3 або 5 типу за класифікацією Академічного консорціуму з вивчення кровотеч [BARC]) та ішемічних подій (ІМ, ішемічний інсульт, доведений тромбоз стента або реваскуляризація цільової судини за клінічними показаннями) упродовж 1 місяця ПАТ і не припиняли ПАТ на період >48 год, були повторно рандомізовані в співвідношенні 1:1 для подальшого отримання ПАТ (за попередньою схемою) або для переходу на монотерапію тикагрелором (90 мг 2 рази на день плюс відповідне плацебо АСК у кишковорозчинній оболонці) – таке лікування тривало ще 11 місяців (друга рандомізація, проведена в рамках дослідження ULTIMATE-DAPT). Цю другу рандомізацію проводили зі стратифікацією за типом ГКС (НС vs ІМбпST vs ІМпST), статусом цукрового діабету (ЦД; так vs ні), результатом першої рандомізації (контроль ВСУЗД vs ангіографічний контроль) і дослідницьким центром [17]. Візити подальшого спостереження виконували через 1 (візит рандомізації в дослідженні ULTIMATE-DAPT), 4, 6 і 12 місяців після виписки зі стаціонару, де проводили індексне ЧКВ. Якщо на тлі тикагрелору розвивалася задишка, дозу знижували з 90 мг 2 рази на день до 60 мг 2 рази на день; якщо задишка зберігалася і на тлі приймання зниженої дози, тикагрелор замінювали на клопідогрель у дозі 75 мг/добу. За наявності клінічних показань під час періоду спостереження проводили контрольну ангіографію. Якщо протягом періоду спостереження учасник проходив процедуру коронарної реваскуляризації, йому призначали ПАТ комбінацією тикагрелор + АСК (дані про результати другої рандомізації залишалися замаскованими до кінця дослідження) [17]. У дослідженні оцінювали дві первинні кінцеві точки (ПКТ): ПКТ переваги (клінічно значуща кровотеча [2, 3 або 5 типи за BARC]) і ПКТ не меншої ефективності (події MACCE, у тому числі серцева смерть, ІМ, ішемічний інсульт, доведений тромбоз стента і реваскуляризація цільової судини за клінічними показаннями). Ключовою вторинною кінцевою точкою був час до розвитку першого явища з комбінації всіх несприятливих клінічних подій (net adverse clinical events, MACCE + будь-які кровотечі [1, 2, 3 або 5 типу за BARC]). Додатковими вторинними кінцевими точками були: велика кровотеча (3 або 5 типу) за BARC, велика або мала кровотеча за шкалою TIMI (Thrombolysis in Myocardial Infarction), помірна, важка або небезпечна для життя кровотеча відповідно до визначень GUSTO (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Arteries), велика кровотеча відповідно до визначень Міжнародного товариства тромбозу і гемостазу (ISTH), окремі компоненти ПКТ і комбінація серцевої смерті, нефатального ІМ та ішемічного інсульту. Іншими вторинними кінцевими точками були неефективність втручання на цільовій судині без розвитку процедурного ІМ, нефатальний ІМ та ймовірний тромбоз стента [17]. Дві основні ПКТ тестували послідовно, тобто для того, щоб перейти до тестування другої ПКТ (ПКТ не меншої ефективності, події МАССЕ), необхідно було спочатку довести наявність значної міжгрупової різниці за частотою подій першої ПКТ (ПКТ переваги, клінічно значущі кровотечі). Подання безперервних даних залежало від розподілу: за нормального розподілу їх подавали як середнє значення (стандартне відхилення [СВ]) і порівнювали з використанням t-критерію, за розподілу, відмінного від нормального, використовували медіану (міжквартильний розмах [МКР]) і U-критерій Манна-Вітні відповідно. Бінарні дані порівнювали з використанням критерію χ2 або точного критерію Фішера. Частоту подій оцінювали з використанням методу Каплана-Майєра, для порівняння показників застосовували логранговий критерій. Ефекти лікування оцінювали з використанням регресії пропорційних ризиків Кокса, а результати представляли як відношення ризиків (ВР) і 95% довірчі інтервали (ДІ). В аналізах обох ПКТ ефекти лікування були скориговані з урахуванням типу ГКС, результату першої рандомізації, статусу ЦД і географічного регіону (Італія, Пакистан, Велика Британія, східний Китай, північний Китай, південний Китай або західний Китай). Первинні аналізи проводилися у вибірці intention-to-treat, що включала всіх рандомізованих пацієнтів, незалежно від дотримання ними режиму приймання досліджуваних препаратів. Крім того, проводили аналізи чутливості на вибірці пацієнтів, що виконали вимоги протоколу, з якої виключали пацієнтів, котрі не приймали досліджуваного лікування впродовж 7 і більше днів (якщо тільки це не було пов’язано з розвитком побічних ефектів) або котрі не дотримувалися графіка приймання препарату (індекс використання препарату <80% від кількості таблеток, виданих на візитах, через 4 і 12 місяців після ЧКВ). І, нарешті, отримані результати додатково перевіряли в підгрупах пацієнтів, заздалегідь виділених на підставі таких ознак, як вік, стать, раса, статус ЦД, наявність ниркової дисфункції, індекс маси тіла, тип ГКС, анамнез ІМ, довжина стента, наявність мультисудинного захворювання і результати першої рандомізації. На значущість відмінностей, виявлених за результатами порівнянь, вказувало значення p<0,05 [17].

Результати дослідження ULTIMATE-DAPT Протягом періоду з 21 вересня 2019 р. до 27 жовтня 2022 р. обстежили 3710 пацієнтів із ГКС, із яких 3505 (94,5%) пройшли першу рандомізацію в групи ВСУЗД і ангіографії, після чого їх виписали з рекомендаціями щодо приймання ПАТ. Через місяць після ЧКВ (медіана 31 день [МКР 30–34] для обох груп) 3400 (97,0%) із цих 3505 пацієнтів пройшли другу рандомізацію для отримання комбінації тикагрелор + плацебо (n=1700) або тикагрелор + АСК (n=1700). Ці 3400 пацієнтів становлять досліджувану вибірку ULTIMATEDAPT. Отримані групи пацієнтів були добре збалансовані як за вихідними клінічними характеристиками (табл. 1), так і за параметрами індексної процедури ЧКВ і за результатами візуалізації (ВСУЗД або ангіографії) [17]. Середній вік пацієнтів становив 63 роки (МКР 54–70), серед них 2521 (74,1%) – чоловіки, а 879 (25,6%) – жінки, у 1075 (31,6%) пацієнтів був ЦД, а у 2024 (59,5%) – гострий ІМ. Із 3400 цільових судин, пов'язаних із розвитком ГКС, у 835 (24,6%) перед проведенням ЧКВ рівень кровотоку був менш ніж 3 ступеня за класифікацією TIMI. Середня тривалість ПАТ становила 28 днів (МКР 25–33) у групі комбінації тикагрелор + плацебо і 365 днів (365–365) у групі комбінації тикагрелор + АСК. Під час спостереження зниження дози тикагрелору з 90 мг до 60 мг 2 рази на день знадобилося 12 (0,7%) пацієнтам у групі тикагрелор + плацебо і 16 (0,9%) пацієнтам у групі тикагрелор + АСК. Перехід із тикагрелору на клопідогрель знадобився у 22 (1,3%) і 19 (1,1%) пацієнтів відповідно. Демаскування результатів рандомізації під час спостереження знадобилося 11 (0,7%) пацієнтам у групі тикагрелор + плацебо і 28 (1,7%) – у групі тикагрелор + АСК через кровотечі 3 або 5 типу за BARC, а також 3 (0,2%) і 5 (0,3%) пацієнтам відповідно – через доведений тромбоз стента. Учасники в обох групах демонстрували задовільну прихильність до антиагрегантної терапії впродовж усього періоду спостереження (за даними візитів через 4 і 12 місяців). Річне клінічне спостереження завершили 3399 (>99,9%) із 3400 учасників. Контрольну ангіографію за клінічними показаннями пройшли 256 (15,1%) пацієнтів із групи тикагрелор + плацебо (медіанний термін – через 347 днів [329–368] після ЧКВ) і 278 (16,4%) пацієнтів із групи тикагрелор + АСК (медіанний термін – через 347 днів [331–370] після ЧКВ) [17].
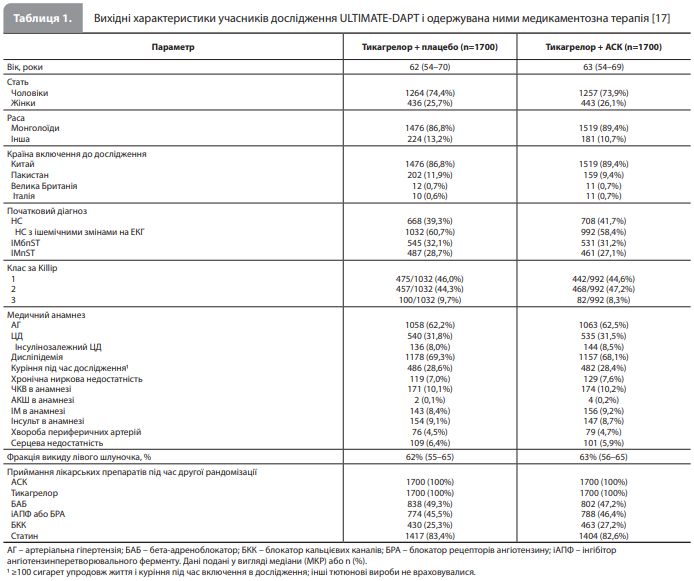
За період спостереження в дослідженні ULTIMATE-DAPT (з першого дня 2-го місяця і до останнього дня 12-го місяця після ЧКВ) ПКТ переваги (клінічно значуща кровотеча) була зареєстрована в 35 пацієнтів (2,1%), які отримували комбінацію тикагрелор + плацебо, і в 78 пацієнтів (4,6%), які отримували комбінацію тикагрелор + АСК (аналіз у вибірці intentionto-treat: ВР 0,45, 95% ДІ 0,30–0,66; p<0,0001) (табл. 2, рис. 1). Аналогічні результати спостерігалися в аналізі чутливості, проведеному у вибірці пацієнтів, які виконали вимоги протоколу. Великі кровотечі (3 або 5 типу за BARC) також рідше реєструвалися в групі комбінації тикагрелор + плацебо порівняно з групою тикагрелор + АСК, як і інші геморагічні кінцеві точки (табл. 2) [17]. Ефекти досліджуваної терапії на ризик клінічно значущої кровотечі (перша ПКТ) були однаковими в усіх заздалегідь визначених підгрупах. Показник «кількість пацієнтів, яких необхідно пролікувати» (number-needed-totreat), становив 40 для запобігання одній клінічно значущій кровотечі й 100 – для запобігання одній великій кровотечі (3 або 5 типу за BARC) [17]. За період спостереження в дослідженні ULTIMATE-DAPT події ПКТ не меншої ефективності (MACCE) були зареєстровані в 61 учасника (3,6%) у групі тикагрелор + плацебо й у 63 (3,7%) учасників у групі тикагрелор + АСК (аналіз у вибірці intention-to-treat: абсолютна різниця -0,1%, 95% ДІ від -1,4 до 1,2%; ВР 0,98, 95% ДІ 0,69–1,39; p для не меншої ефективності <0,0001, p для переваги 0,89) (табл. 2, рис. 2). Аналогічні результати були отримані в аналізі чутливості, проведеному у вибірці пацієнтів, які виконали вимоги протоколу. Групи також були зіставними за показниками частоти окремих компонентів другої ПКТ і за іншими ішемічними кінцевими точками (табл. 2). Ефекти досліджуваного лікування на ризик MACCE були однаковими в усіх заздалегідь визначених підгрупах, крім підгруп, виділених з урахуванням віку пацієнтів (≥ 65 vs <65 років; р для взаємодії 0,016) [17]. За період спостереження в дослідженні ULTIMATEDAPT події ключової вторинної кінцевої точки (комбінація всіх несприятливих клінічних подій) реєстрували рідше в групі тикагрелор + плацебо, аніж у групі тикагрелор + АСК (табл. 2) [17].
Обговорення результатів дослідження ULTIMATE-DAPT Загалом, рандомізоване плацебо-контрольоване подвійне сліпе дослідження ULTIMATE-DAPT показало, що в пацієнтів із ГКС, які пройшли ЧКВ із наступним прийманням ПАТ комбінацією тикагрелор + АСК упродовж місяця, подальша 11-місячна монотерапія тикагрелором була пов'язана зі зниженням ризику клінічно значущих кровотеч без супутнього збільшення частоти подій MACCE порівняно з продовженням ПАТ протягом додаткових 11 місяців. Цей результат підтверджує гіпотезу, згідно з якою після ЧКВ з імплантацією сучасних СЛП із приводу коронарних синдромів більша частина протиішемічного захисту ПАТ зумовлена ефектами іP2Y12, у той час як АСК є причиною багатьох геморагічних ускладнень [5–11]. Слід зазначити, що дослідження цієї гіпотези проводили і до ULTIMATE-DAPT, однак вони мали цілу низку обмежень, які суттєво впливали на достовірність отриманих результатів (відкритий режим лікування і відсутність контролю плацебо, різна тривалість ПАТ перед переходом на монотерапію іP2Y12, різні іP2Y12, які застосовували в складі ПАТ, використання різних визначень кровотеч, оцінювання когорти пацієнтів із ГКС як підгрупи в складі ширшої вибірки, включення в оцінку первинної кінцевої точки подій, що відбулися в загальній вибірці під час отримання ПАТ [тобто в передрандомізаційному періоді]) [17]. Ці обмеження і пов'язана з ними відсутність надійних даних перешкоджали широкому прийняттю ідеї раннього переходу на монотерапію потужним іP2Y12 після ЧКВ і лише 1 місяця ПАТ у пацієнтів із ГКС. Усі ці недоліки попередніх досліджень було враховано в дизайні ULTIMATE-DAPT, і в результаті було отримано більш достовірні дані, які, водночас, не суперечили результатам більш ранніх досліджень. Слід зазначити, що загальний висновок дослідження ULTIMATE-DAPT про зниження геморагічного ризику без збільшення ризику тромботичних або ішемічних подій підтвердився і в аналізах з використанням інших визначень кровотеч (велика кровотеча за BARC, кровотечі за визначеннями TIMI, GUSTO й ISTH), і в аналізі на вибірці пацієнтів, які виконали вимоги протоколу (первинні аналізи проводили на вибірці intention-to-treat), і в аналізах усіх заздалегідь визначених підгруп пацієнтів (хоча аналіз МАССЕ в підгрупах показав взаємодію ефекту лікування з віком пацієнтів). Крім того, було виявлено достовірне зниження ризику ключової вторинної кінцевої точки – комбінації всіх несприятливих клінічних подій – на тлі монотерапії тикагрелором (ВР 0,68 [95% ДІ 0,53–0,88]), тобто поліпшення загального результату лікування за умови використання цієї схеми антиагрегантної терапії. І, нарешті, відповідно до результатів більш ранніх досліджень, в ULTIMATE-DAPT перехід на монотерапію тикагрелором був пов'язаний із безпечним зниженням ризику великих і малих / незначних кровотеч під час подальшого спостереження.З огляду на сукупність отриманих результатів представлений варіант антиагрегантної терапії з раннім скасуванням АСК може особливо підходити для лікування пацієнтів із високим ризиком геморагічних ускладнень (наприклад, пацієнтів зі старечою астенією, осіб віком від 65 років, пацієнтів з анемією або анамнезом кровотеч, а також пацієнтів із хронічною хворобою нирок) [17]. Дослідження ULTIMATE-DAPT має низку обмежень, які необхідно враховувати для правильного розуміння отриманих результатів. Передусім – це дуже високий відсоток учасників із Китаю (88,1%), що, попри відсутність ознак взаємодії між географією дослідницьких центрів і клінічними результатами, може знизити узагальнюваність отриманих даних. Крім того, отримані результати можуть бути не застосовні до пацієнтів із раніше перенесеним АКШ або з іншими станами / захворюваннями, перерахованими в критеріях виключення. До того ж, отримані результати специфічні для монотерапії тикагрелором, не можуть бути застосовані до використання прасугрелю або клопідогрелю і не дають уявлення про оптимальний режим антиагрегантної терапії після завершення року після ЧКВ [17].
Висновки У цій статті представлено результати ULTIMATEDAPT – першого великомасштабного рандомізованого плацебо-контрольованого подвійного сліпого дослідження, яке порівнювало результати монотерапії тикагрелором із результатами продовження ПАТ комбінацією тикагрелор + АСК в інтервалі від 2-го до 12-го місяця після ЧКВ з імплантацією СЛП у пацієнтів з ГКС і без несприятливих подій на тлі початкової 1-місячної ПАТ. Отримані результати показали, що використання монотерапії тикагрелором у таких пацієнтів пов'язане зі зниженням ризику клінічно значущих (великих і малих) кровотеч без порушення протиішемічного захисту порівняно з подальшим застосуванням комбінації тикагрелор + АСК. Ці результати отримали підтвердження в аналізі ключової вторинної кінцевої точки (комбінація всіх несприятливих клінічних подій), в аналізі чутливості та аналізах у заздалегідь визначених підгрупах пацієнтів. Очікується, що подальші аналізи даних з ULTIMATE-DAPT дадуть змогу виявити конкретні категорії пацієнтів із різними співвідношеннями ішемічного й геморагічного ризиків, які можуть отримати найбільшу користь від раннього переходу з ПАТ на монотерапію тикагрелором після ЧКВ із приводу ГКС.
Список літератури знаходиться в редакції
Автор огляду Наталія Генш Medicine Review 2024; 5 (78): 11 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |