Діагностика й лікування саркоїдозу серця: основні положення наукової заяви АНА (2024)Саркоїдоз серця (кардіосаркоїдоз, КС) – це інфільтративна кардіоміопатія (КМП), зумовлена гранулематозним запаленням міокарда, що найчастіше проявляється порушенням провідності з високим ступенем блокади серця, розвитком шлуночкових аритмій (ША) та/або дисфункцією лівого шлуночка (ЛШ). Точна діагностика КС ускладнена через різноманітність та неспецифічність клінічних проявів і вимагає обов'язкового проведення мультимодальної візуалізації з оцінкою результатів на рівні міждисциплінарної комісії. Вплив КС на захворюваність і смертність визначає значущість своєчасної і точної діагностики захворювання з подальшою організацією терапії, однак через відсутність рандомізованих клінічних досліджень КС сучасні стратегії діагностики й лікування ґрунтуються в основному на результатах когортних досліджень і узгодженій думці експертів. Наслідком цього є істотні відмінності в підходах щодо ведення КС, особливо – до застосовуваної терапії, що призвело експертів Американської кардіологічної асоціації (American Heart Association, АНА) до розроблення та публікації наукової заяви з питань ведення хворих на КС, яка стисло представлена в цьому огляді [1].
Патофізіологія та епідеміологія КС Точні причини розвитку й патофізіологія саркоїдозу потребують подальшого вивчення, проте найімовірніша гіпотеза припускає, що до розвитку КС веде вплив комбінації чинників довкілля (зокрема пліснявих грибків, інсектицидів та/або кремнеземного пилу), невідомого антигену й наявності генетичної схильності. Повногеномні дослідження виявили вплив спадкової схильності, пов'язаної з алелями генів тканинної сумісності (HLA) класу II, що зумовлює підвищений ризик розвитку КС у людей із родинним анамнезом саркоїдозу, а також впливає на тяжкість захворювання. Імунологічні дослідження продемонстрували зв'язок КС із суттєвими порушеннями регуляції Т-клітинної відповіді у вигляді активації Т-хелперів 1 типу й посиленого вироблення цитокінів і хемокінів, таких як інтерферон-γ, фактор некрозу пухлини (ФНП)-α, трансформувальний фактор росту-β, інтерлейкін (ІЛ)-2 та ІЛ-12. Порушення відповіді регуляторних Т-лімфоцитів призводить до стійкої місцевої ефекторної відповіді Т-лімфоцитів на тканинні антигени. Підсумком цих імунологічних порушень стає активація макрофагів з утворенням ненекротичних запальних (так званих неказеозних) гранульом у будь-якому органі, зокрема й у серці. Активне запалення (активна фаза КС) може перейти у фіброзну фазу, і кожна із цих фаз може протікати з розвитком серцевої дисфункції. Захворюваність і поширеність саркоїдозу широко варіюються залежно від географічного регіону, статі й раси. У Сполучених Штатах поширеність системного саркоїдозу становить 35,2 випадку на 100 000 населення з вищою захворюваністю і поширеністю КС серед афроамериканців [1]. Поширеність системного саркоїдозу також вища серед жінок порівняно з чоловіками. Крім того, мабуть, існують расові відмінності в імовірності ураження серця, оскільки КС особливо поширений у японській популяції. До того ж, є ознаки залежності клінічного фенотипу КС від раси й статі, оскільки симптоматична серцева недостатність (СН), пов'язана з КС, частіше зустрічається в негроїдів порівняно з європеоїдами й у жінок порівняно з чоловіками, в той час як ША, пов’язані з КС, частіше реєструються в чоловіків, ніж у жінок [1].
Клінічна картина КС У людей із системним саркоїдозом найчастіше (у 90% випадків) уражаються легені. Ураження серця виявляють у ≈20% пацієнтів із системним саркоїдозом, скерованих на обстеження методами променевої діагностики, однак клінічно маніфестне захворювання трапляється тільки в ≈5% [1]. Деякі клінічні сценарії мають розглядатися як підозрілі й вимагають виключити діагноз КС. До них відносяться незрозуміла атріовентрикулярна блокада (АВ) високого ступеня в людини віком <60 років, незрозуміла ША або такі результати ехокардіографії (ЕхоКГ), як зниження фракції викиду (ФВ) ЛШ, локальна аневризма стінки серця або стоншення основи перегородки за відсутності ішемічної хвороби серця або іншого причинного захворювання. Серед результатів лабораторних аналізів звертає увагу гіперкальціємія, яка може розвинутися внаслідок збільшення продукції 1,25-дигідроксивітаміну D в активованих макрофагах [1]. Клінічна картина КС залежить від локалізації, поширеності та активності гранулематозної інфільтрації міокарда. Наприклад, в осіб з ураженням основи міжшлуночкової перегородки частіше спостерігається блокада серця, тоді як у пацієнтів з обширним фіброзом міокарда частіше розвиваються шлуночкова систолічна дисфункція та СН. Крім того, присутність фіброзу й ступінь заміщення міокарда фіброзною тканиною тісно пов'язані з розвитком ША, причому ураження правого шлуночка (ПШ) асоціюється з більш високим ризиком ША. Значна частина пацієнтів із КС спочатку звертається по допомогу у зв'язку з розвитком кардіальних симптомів, і приблизно в 49–65% з них відсутні очевидні клінічні ознаки саркоїдозу інших органів [1]. Проте при всебічному обстеженні в більшості пацієнтів із КС буде виявлено системний саркоїдоз, що підкреслює важливість ретельної оцінки стану всіх внутрішніх органів. Дані про поширеність ізольованого КС ненадійні через відмінності в застосовуваних стратегіях діагностики й валідації діагнозу. До того ж, у випадках виявлення клінічно ізольованого КС необхідно виключити інші причини ураження серця, зокрема спадкову КМП [1].
Діагностика Основними методами інструментальної діагностики КС є електрокардіографія (ЕКГ), ЕхоКГ, магнітно-резонансна томографія (МРТ) серця та позитронно-емісійна томографія (ПЕТ) серця [1]. ЕКГ і ЕхоКГ мають обмежену чутливість, але можуть викликати підозру на наявність КС. У результатах ЕКГ до таких підозрілих змін відносяться сповільнення провідності, АВ блокада, фрагментовані комплекси QRS, а також блокада правої або лівої ніжки пучка Гіса. Результати добового холтерівського моніторування можуть посилити підозру на наявність КС при виявленні частих шлуночкових екстрасистол, порушень провідності високого ступеня або ША. До результатів ЕхоКГ, підозрілих на КС, належать зниження ФВ ЛШ, локальна аневризма стінки серця, стоншення основи міжшлуночкової перегородки й зміна глобальної поздовжньої деформації міокарда. Крім того, ЕхоКГ, через її широку доступність і низьку вартість, може бути корисною для скринінгу на наявність КС і диспансерного спостереження. Однак у пацієнтів із КС можуть бути отримані абсолютно нормальні результати ЕКГ та/або ЕхоКГ, тому основними методами візуалізації для точної діагностики КС є МРТ серця та/або ПЕТ серця з фтор-18-фтордезоксиглюкозою (ФДГ-ПЕТ) [1]. МРТ-маркером ураження міокарда за наявності КС є феномен пізнього накопичення гадолінію (ПНГ), який дає змогу визначити локалізацію і провести кількісну оцінку уражених ділянок міокарда. Гадоліній – це позаклітинний контраст із високою швидкістю виведення з нормального міокарда, яка знижується в ділянках фіброзу й запалення, що призводить до феномену ПНГ. За даними метааналізу 17 досліджень (n=1031) МРТ серця з гадолінієм має високу чутливість (95%) і специфічність (85%) для діагностики КС [2]. Важливо зазначити, що ПНГ у міокарді також має значну прогностичну цінність як найсильніший предиктор смертності від усіх причин і розвитку стійкої ША серед осіб із відомим або підозрюваним КС. У науковій заяві АНА експерти вказують на відсутність специфічних змін на МРТ серця, патогномонічних для саркоїдозу, але при цьому наводять результати двох цікавих досліджень, що потенційно можуть полегшити виявлення хворих на КС [3, 4]. Перша робота (Okasha et al.) – це систематичний огляд і метааналіз даних, отриманих за допомогою оцінки макроскопічних знімків сердець пацієнтів із гістологічно діагностованим КС (аутопсійний матеріал або експлантоване серце). При цьому було виявлено деякі часті й рідкісні варіанти ураження міокарда внаслідок КС. До першої групи належали субепікардіальне, септальне й багатовогнищеве ураження ЛШ, а також ураження вільної стінки ПШ – ці зміни спостерігалися в >90% випадків. До другої групи входили випадки відсутності макроскопічних ознак ураження міокарда, ізольоване ураження середніх шарів міокарда ЛШ, ізольоване субендокардіальне ураження ЛШ і відсутність ознак ураження перегородки серця [3]. У другому дослідженні, проведеному Athwal et al., автори порівняли зміни, виявлені на МРТ серця (локалізацію ділянок із ПНГ) у 504 пацієнтів із згодом гістологічно верифікованим діагнозом КС, із частими й рідкісними макроскопічними варіантами ураження міокарда з дослідження Okasha et al. [4]. У цій когорті пацієнтів частка пацієнтів із ПНГ у часто уражуваних ділянках із дослідження Okasha et al. становила 20,4%, а в рідко уражуваних ділянках – 11,5%. При цьому наявність ПНГ у часто уражуваних ділянках асоціювалася з високим ризиком аритмій незалежно від ФВ ЛШ і ступеня ПНГ, а відсутність ПНГ у цих ділянках була пов'язана з низьким ризиком аритмій навіть за наявності ПНГ іншої локалізації або зниженої ФВ ЛШ [4]. Ці дані підтверджують думку про те, що особливості ПНГ можна використовувати для кращої оцінки ймовірності наявності КС і що певні патерни ПНГ із більшою імовірністю будуть пов'язані з несприятливим прогнозом. Однак навіть виявлення характерних патернів ПНГ недостатньо для діагностики КС, оскільки схожі зміни можуть виявлятися і при інших патологічних процесах, наприклад при гігантоклітинному міокардиті. Більше того, відсутність ознак ПНГ на МРТ серця не дає змоги однозначно виключити КС, оскільки може зустрічатися на ранніх етапах захворювання [1]. Практичні переваги МРТ перед ФДГ-ПЕТ серця включають відсутність необхідної підготовки пацієнта, високу негативну прогностичну цінність результатів (для виключення КС і для виявлення пацієнтів із низьким ризиком ускладнень), а також допомогу у виявленні конкуруючих діагнозів, таких як аритмогенна КМП ПШ, міокардит і попередній інфаркт міокарда (ІМ). Нині МРТ і ФДГ-ПЕТ вважають взаємодоповнюючими методами діагностики КС. На практиці МРТ часто використовують як початковий метод діагностики для осіб із низькою клінічною підозрою на КС, тоді як за вищої попередньої ймовірності КС проводять як МРТ, так і ФДГ-ПЕТ [1]. ФДГ-ПЕТ (зазвичай у поєднанні з МРТ) проводять для оцінки активності захворювання і моніторингу відповіді на лікування КС, а також у випадках, коли зберігається висока попередня ймовірність КС, незважаючи на негативні, неінформативні або сумнівні результати МРТ, або в ситуаціях, коли МРТ протипоказана пацієнту. За наявності клінічної підозри на екстракардіальний саркоїдоз (ЕКС) у пацієнтів, які не проходили нещодавно обстеження на ЕКС, необхідно провести обмежену ПЕТ-КТ усього тіла (з використанням тієї самої ін'єкції ФДГ, що вводилась для обстеження на наявність КС), щоб оцінити характеристики екстракардіального розподілу ФДГ. Це дасть змогу виявити потенційні ділянки для проведення біопсії або визначитися з необхідністю призначення системної імуносупресивної терапії [1]. ФДГ-ПЕТ виявляє метаболічно активні запальні вогнища, оскільки ФДГ, аналог глюкози, секвеструється в активованих запальних клітинах, таких як макрофаги й лімфоцити, за допомогою інсулінонезалежних білків-переносників глюкози (GLUT1 і GLUT3) і, у такий спосіб, накопичується в ділянках підвищеного метаболізму глюкози, таких як гіперметаболічні ділянки інфільтрації міокарда при саркоїдозі. Важливо зазначити, що глюкоза є звичайним джерелом енергії і для здорових клітин міокарда, але, на відміну від запальних клітин, кардіоміоцити поглинають глюкозу за допомогою інсулінозалежного механізму (GLUT4), регульованого голодуванням і складом раціону. Як наслідок, «метаболічне перемикання» серця у вигляді переходу від утилізації глюкози на утилізацію жирних кислот і кетонів дає змогу знизити поглинання ФДГ здоровим міокардом (за допомогою пригнічення транслокації GLUT4) і полегшити ідентифікацію запальних клітин, що поглинають ФДГ. Таке метаболічне перемикання досягається голодуванням і дотриманням низьковуглеводної дієти з високим споживанням жирів упродовж як мінімум 24 годин перед обстеженням. Через добу такої дієти пригнічення поглинання ФДГ здоровим міокардом досягається у ≈80% пацієнтів, через 72 години ця цифра збільшується до 95% [1]. Характерною ознакою КС при ФДГ-ПЕТ є мультифокальне поглинання ФДГ, особливо коли воно пов'язане з дефектами перфузії в спокої або поєднується з ознаками екстракардіального запалення. Однак іноді, наприклад у пацієнтів із блокадою серця, єдиною ознакою КС може бути вогнище поглинання ФДГ усередині міжшлуночкової перегородки. Більше того, повна відсутність ознак поглинання ФДГ міокардом також можлива при КС, наприклад, на пізньому етапі саркоїдозу, коли метаболічно активні гранульоми замінюються метаболічно неактивною фіброзною тканиною. Також можливі й хибнопозитивні результати ФДГ-ПЕТ, що виникають, наприклад, унаслідок неповного фізіологічного пригнічення процесу поглинання глюкози в ситуаціях, пов'язаних з ішемізованим (гібернуючим) міокардом, за наявності інших форм дилатаційної, запальної або генетичної КМП чи після нещодавно перенесеного ІМ. Крім того, нещодавно перенесене втручання на серці, наприклад абляція з приводу ША, може викликати гостре запалення і, як наслідок, призвести до хибнопозитивних результатів ФДГ-ПЕТ [1]. Нині існують два поширені варіанти діагностики КС. Перший варіант передбачає пряме гістологічне підтвердження наявності неказеозних гранульом (за відсутності альтернативної причини) в тканині міокарда, отриманої за допомогою ендоміокардіальної біопсії (ЕМБ), трепан-біопсії верхівки ЛШ або з експлантованого серця. При цьому ЕМБ має обмежену чутливість через неоднорідність інфільтрації міокарда. Другий варіант передбачає постановку діагнозу на основі комбінації низки клінічних, патоморфологічних критеріїв і критеріїв, які оцінюються за допомогою методів візуалізації. Тобто нині вважають, що результатів однієї тільки мультимодальної візуалізації недостатньо для підтвердження діагнозу КС. Пропонований експертами АНА алгоритм діагностики КС представлений на рисунку 1.
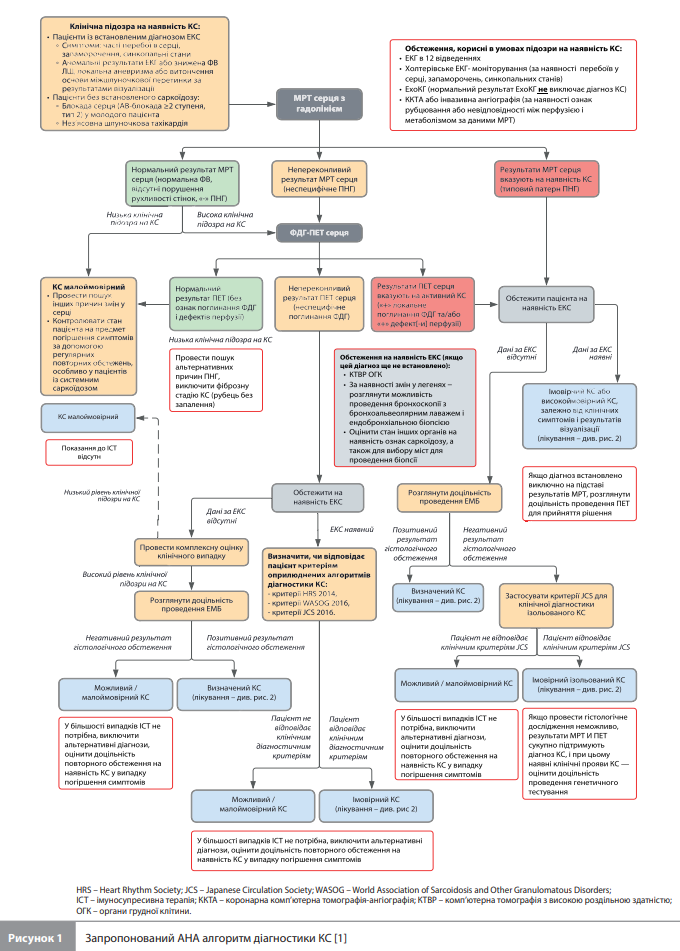
Лікування КС Експерти АНА рекомендують розпочинати терапію саркоїдозу в пацієнтів із симптомами й встановленим або високоймовірним діагнозом КС. У разі ймовірного КС рішення про терапію має ухвалюватися спільно з пацієнтом за результатами обговорення ризиків і переваг лікування. За наявності можливого / малоймовірного КС лікування в більшості випадків не проводять через невизначеність діагнозу, користі й потенційної шкоди терапії. При малоймовірному КС зазвичай немає показань до імуносупресії [1]. 1. Імуномодулятори. До теперішнього часу імуномодулююча терапія КС не вивчалася в рандомізованих контрольованих дослідженнях. Таку терапію зазвичай призначають пацієнтам із клінічними проявами КС, включно із ША, вираженою АВ блокадою або СН на тлі активного запалення. Необхідність призначення терапії безсимптомним пацієнтам із результатами ФДГ-ПЕТ серця, що відповідають активному запаленню, дотепер не визначено; відповідне рішення має ухвалюватися індивідуально [1]. Кортикостероїди нині вважають терапією КС першої лінії. Кортикостероїди можуть покращити міокардіальну провідність при АВ блокаді, однак їхня користь для інших аритмій, дисфункції ЛШ і смертності залишається неясною. Рекомендована доза становить 30–40 мг/добу еквівалента преднізону, ефективність вищих початкових доз не встановлена. За небезпечних для життя проявів, включно з кардіогенним шоком, можна застосовувати вищі початкові дози кортикостероїдів (до 1000 мг/добу) доти, доки не будуть виключені інші причини гострого запалення (наприклад, гігантоклітинний міокардит). Слід зазначити, що приблизно в 75% випадків спостерігається рецидив симптоматичного КС після поступового зниження дози кортикостероїдів [5]. Для зниження потреби в кортикостероїдах до схеми лікування можуть бути додані імунодепресанти, наприклад метотрексат, мікофенолат, азатіоприн, інфліксимаб, адалімумаб і ритуксимаб. Така комбінована терапія може розглядатися на початку лікування КС при тяжких клінічних проявах або в пацієнтів із непереносимістю помірних і високих доз кортикостероїдів. За рекомендованого АНА багаторівневого підходу до лікування (рис. 2) препарат другої лінії (метотрексат, мікофенолат, азатіоприн або лефлуномід) додають до кортикостероїдів у пацієнтів із рецидивом або триваючим запаленням на тлі терапії кортикостероїдами. Якщо подальша ФДГ-ПЕТ виявляє ознаки триваючого запалення, то до схеми лікування додають препарати, що діють проти ФНП-&alpha., тобто інфліксимаб або адалімумаб (препарати третьої лінії). Слід зазначити, що використання цих препаратів потребує обережності в осіб зі зниженою ФВ і симптомами III–IV функціонального класу за класифікацією Нью-Йоркської кардіологічної асоціації, оскільки попередні дослідження виявили потенційну шкоду такого лікування для пацієнтів із СН [6]. Із цієї ж причини пацієнти з КС і КМП, які отримують інгібітори ФНП-α, підлягають регулярному моніторингу з ЕхоКГ та оцінкою волемії [1].
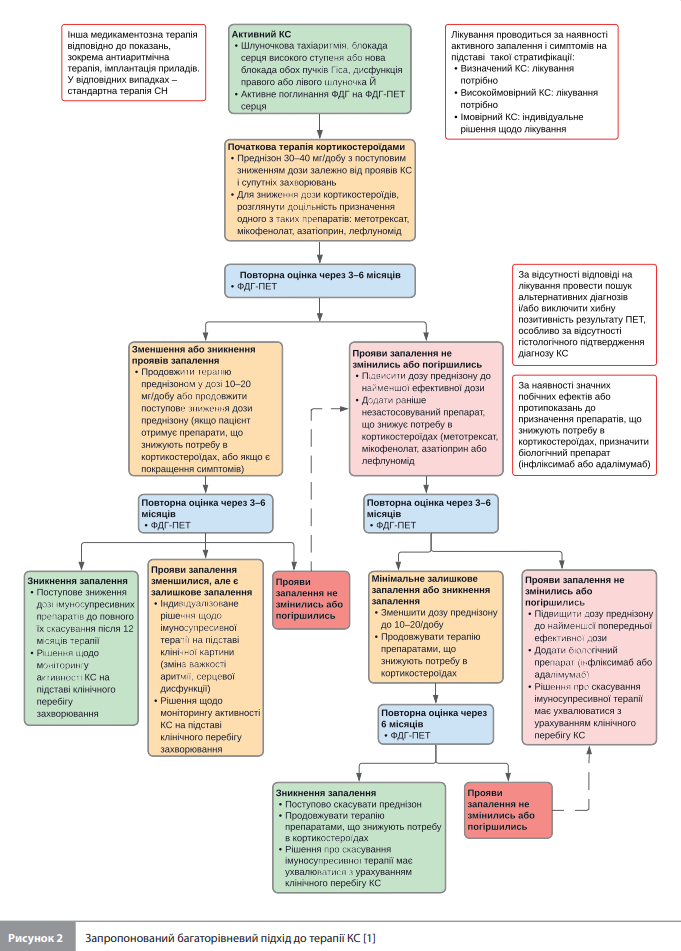
На ефективність лікування вказують зменшення тяжкості або зникнення клінічних проявів КС, тобто аритмій, блокади серця та/або СН, і зниження ступеня активного гранулематозного запалення в міокарді, визначене за ступенем поглинання ФДГ. Під час активної терапії повторні ФДГ-ПЕТ-сканування зазвичай проводяться з інтервалом 3–6 місяців. Якщо, незважаючи на зникнення клінічних симптомів, запалення за даними ФДГ-ПЕТ зберігається, то лікування може бути продовжене з урахуванням низки чинників, зокрема тяжкості попередніх проявів КС, ризику несприятливого наслідку в разі розвитку побічних ефектів, ризику продовження чи посилення імуномодулюючої терапії, а також ступеня змін на ФДГ-ПЕТ. Для моніторингу з метою виявлення рецидивів захворювання застосовують різні підходи, що включають моніторинг серцевого ритму, ЕхоКГ і ПЕТ-КТ. 2. Терапія КМП. Лікування КМП, пов’язаної із саркоїдозом, слід проводити з урахуванням специфічного фенотипу СН, що може бути представлений систолічною дисфункцією ЛШ, переважною систолічною дисфункцією ПШ або СН зі збереженою ФВ ЛШ, яка згодом може трансформуватися в рестриктивну дисфункцію ЛШ унаслідок зменшення розтяжності шлуночків. Для лікування зазвичай застосовують препарати з категорії науково-обґрунтованої терапії (НОМТ) СН, попри відсутність спеціальних досліджень цих препаратів в умовах КС. Для лікування дисфункції ЛШ призначають β-блокатори, блокатори ренін-ангіотензинової системи, антагоністи мінералокортикоїдних рецепторів та інгібітори натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ2). Остання група препаратів також рекомендується для пацієнтів із СН зі збереженою ФВ ЛШ. Для симптоматичного лікування перевантаження об'ємом застосовують діуретики. Якщо, незважаючи на імуносупресію і НОМТ, СН прогресує, можна розглядати застосування передових методів лікування СН, а саме механічну підтримку кровообігу й трансплантацію серця. 3. Антиаритмічна терапія. Аритмічні прояви КС зумовлені присутністю гранульом, що спричиняють порушення з боку провідної системи серця, розвиток передсердних або шлуночкових аритмій залежно від анатомічної локалізації, тяжкості ураження і стадії запалення. Порушення провідності є одним із найчастіших проявів КС: під час постановки діагнозу 26–43% пацієнтів мають блокаду правої ніжки пучка Гіса на ЕКГ, а у великої кількості пацієнтів із клінічно ізольованим КС спостерігається високоступенева або повна симптоматична блокада серця [7]. Більш того, обстеження осіб віком від 18 до 60 років із повною блокадою серця показали, що в 34% із них був недіагностований КС, що робить незрозумілу блокаду серця в молодих людей показанням до обстеження на наявність КС [1]. Важливо відзначити, що люди з блокадою серця, спричиненою КС, мають незвично високий ризик ША, трансплантації серця або серцевої смерті, внаслідок чого було розроблено консенсусну рекомендацію експертів класу IIa зі встановлення імплантованого кардіовертера-дефібрилятора (ІКД) особам із КС і показаннями до кардіостимуляції [8]. Частота відновлення функції провідної системи на тлі лікування КС варіюється в діапазоні від 24 до 100%, що, імовірно, залежить від того, що саме – запалення чи фіброз – є причиною блокади серця [9]. Передсердні аритмії також часто стають проявом КС. Так, в одному одноцентровому дослідженні за участю пацієнтів із КС поширеність фібриляції передсердь (ФП) становила 32% [10]. Обмежені дані дають змогу припускати, що імуносупресивна терапія дозволяє зменшити ризик розвитку й тяжкість передсердних аритмій [11]. Застосування антикоагулянтів, антиаритмічних препаратів, а також виконання процедури абляції з приводу ФП при КС не відрізняється від таких за відсутності КС [12]. Водночас, ША – шлуночкова тахікардія і фібриляція – є одними з найнебезпечніших первинних проявів або ускладнень КС і потребують комплексного підходу до терапії з використанням імуносупресорних, антиаритмічних препаратів та абляції [8]. Зазвичай антиаритмічні препарати використовують спільно з імуномодуляторами за наявності запалення і без імуномодуляторів – якщо ознаки запалення відсутні [13]. У деяких пацієнтів із рефрактерними ША можна розглянути можливість проведення симпатичної денервації серця. Якщо й цей підхід виявиться неефективним (рефрактерність ША зберігається), рекомендується розглянути можливість трансплантації серця. З повним текстом документа англійською мовою можна ознайомитися на сайті https://www.ahajournals.org.
Список літератури знаходиться в редакції
Автор огляду Микола Горін |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |