Ризики кровотечі й ішемічних подій на тлі монотерапії тикагрелором після ЧКВ: новий аналіз результатів дослідження TWILIGHTНа сьогодні основою стратегії зі зниження ризику тромбозу стента й інфаркту міокарда (ІМ) після черезшкірного коронарного втручання (ЧКВ) є подвійна антиагрегантна терапія (ПАТ) комбінацією ацетилсаліцилової кислоти (АСК) та інгібітора P2Y12-рецепторів тромбоцитів (іP2Y12) [1]. Проте, паралельно з достовірним зниженням ризику тромботичних подій після імплантації коронарних стентів ПАТ істотно збільшує ризик кровотечі, особливо при використанні потужних іP2Y12 прасугрелю й тикагрелору [2–7], що суттєво послаблює сприятливий ефект на прогноз після ЧКВ [8, 9]. Пошук способів зниження геморагічного ризику, пов'язаного з ПАТ, дав змогу ідентифікувати кілька потенційно ефективних стратегій, однією з яких стало вкорочення ПАТ шляхом відміни одного з її компонентів (АСК або іP2Y12) після нетривалої (1–3 місяці) комбінованої терапії [10]. Подальші рандомізовані клінічні дослідження (РКД) підтвердили безпеку (тобто надійний протиішемічний захист) підходу з використанням укороченої ПАТ в умовах застосування нового покоління коронарних стентів із лікарським покриттям (СЛП), що дало змогу перейти до порівняння результатів короткострокової ПАТ із подальшим раннім переходом на довгострокову монотерапію іP2Y12 із результатами стандартної ПАТ у рамках РКД [11]. У дослідженні TWILIGHT (Ticagrelor With Aspirin or Alone in High-Risk Patients After Coronary Intervention) за участю пацієнтів, які перенесли ЧКВ високого ризику з імплантацією СЛП нового покоління, монотерапія тикагрелором після 3-місячної ПАТ була пов'язана з ефективним і безпечним зниженням ризику кровотеч порівняно зі стандартною 12-місячною ПАТ [12]. Проте, незважаючи на сприятливі результати РКД, залишається нерозв'язаною проблема клінічної оцінки ризику в окремого пацієнта, який пройшов ЧКВ, зокрема у зв'язку з відсутністю моделей оцінки ризику (МОР), які дають змогу одночасно оцінити ризик ішемії та ризик кровотечі впродовж року після ЧКВ за умов застосування стратегії «короткострокова (3 місяці) ПАТ із подальшою монотерапією іP2Y12». Одне вирішення цієї проблеми запропонували Mendieta et al., які використали дані дослідження TWILIGHT і розробили дві багатоваріантні моделі прогнозування (1) кровотеч 2, 3 або 5 типу за класифікацією Академічного консорціуму з вивчення кровотеч (BARC-2/3/5) і (2) серйозних несприятливих серцево-судинних (СС) і цереброваскулярних подій (MACCE), таких як СС смерть, несмертельний ІМ і несмертельний ішемічний інсульт, за допомогою низки вихідних простих для визначення факторів ризику, пов'язаних із пацієнтом і процедурою ЧКВ [13]. На думку авторів, виявлення факторів, найтісніше пов’язаних із ризиками кровотечі та ішемії, може допомогти в оцінці клінічної користі монотерапії тикагрелором порівняно зі стандартною ПАТ у реальних пацієнтів. Використовуючи зазначені моделі, Mendieta et al. розподілили учасників TWILIGHT за відповідними підгрупами ризику й провели аналіз результатів дослідження в отриманих підгрупах, щоб повторно переконатися в доцільності нової антиагрегантної стратегії, що вивчалася в TWILIGHT. Результати цієї роботи стило представлені нижче.

Основні характеристики дослідження TWILIGHT і аналізу Mendieta et al. У дослідженні TWILIGHT брали участь пацієнти, які перенесли успішну імплантацію СЛП і відповідали хоча б одному клінічному й одному ангіографічному критерію ЧКВ високого ризику [14]. Основними критеріями виключення з дослідження були ІМ із підйомом сегмента ST, «рятівне» ЧКВ, наявність показань до приймання пероральних антикоагулянтів і планова коронарна реваскуляризація. З липня 2015 р. по грудень 2017 р. у дослідженні взяли участь 9006 пацієнтів. Усі ці пацієнти після ЧКВ спочатку пройшли 3-місячну відкриту терапію комбінацією тикагрелору (90 мг 2 рази на день) і АСК (81–100 мг на день) (тобто отримали 3-місячну ПАТ), після чого 7119 учасників, які ретельно дотримувалися режиму лікування й не мали небажаних (ішемічних або геморагічних) явищ на тлі 3-місячної ПАТ, були рандомізовані в співвідношенні 1:1 для приймання АСК або плацебо на додачу до подальшої відкритої терапії тикагрелором у попередній дозі протягом 12 місяців. Первинною кінцевою точкою TWILIGHT був час до першої кровотечі BARC-2/3/5 протягом 12 місяців спостереження після рандомізації. Ключовою вторинною ішемічною кінцевою точкою була комбінація ІМ, інсульту й смерті від будь-якої причини. Додатковою вторинною ішемічною кінцевою точкою була комбінація подій МАССЕ, що включала СС смерть, несмертельний ІМ або несмертельний ішемічний інсульт. У своєму аналізі Mendieta et al. вивчали зв’язок між вихідними значеннями змінних, пов'язаних із пацієнтом та індексною процедурою, і результатами лікування, зокрема з первинною (кровотечі BARC-2/3/5) і додатковою вторинною (МАССЕ) кінцевими точками, за допомогою багатопараметричних моделей пропорційних ризиків Кокса. Для оцінки ефекту досліджуваної терапії з урахуванням вихідного рівня ризику розраховували кількість і частоту подій за категоріями (підгрупами) ризику й групами лікування. Також розраховували міжгрупову різницю абсолютних і відносних річних ризиків для пацієнтів із кожної категорії ризику та оцінювали взаємодію між лікуванням і підгрупами ішемічного й геморагічного ризиків. Для вивчення впливу несмертельних кровотеч (2 і 3 типи за BARC, BARC-2/3) і несмертельних ішемічних подій (ІМ та ішемічний інсульт) на смертність від будь-яких причин використовували регресійну модель пропорційного ризику Кокса. Результати вважали статистично значущими за двостороннього значення р<0,05.
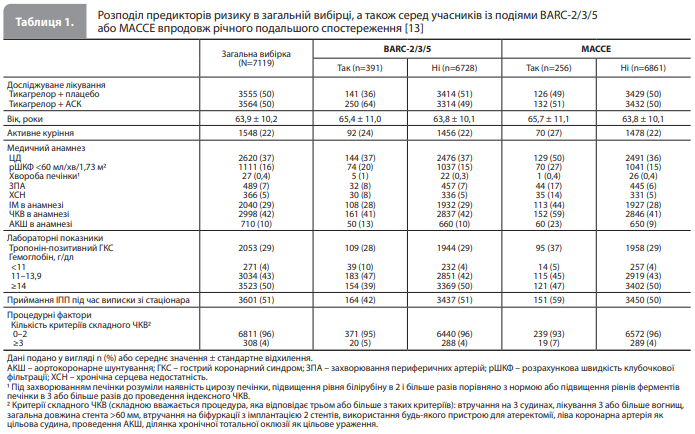
Результати аналізу Mendieta et al. Упродовж 12-місячного спостереження після рандомізації кровотечі BARC-2/3/5 були зареєстровані у 391 (5,5%) пацієнта, а події вторинної ішемічної кінцевої точки (MACCE) – у 258 (3,6%) рандомізованих пацієнтів (N=7119). Розробка МОР. Після оцінки 33 факторів-кандидатів (17 для МОР кровотеч BARC-2/3/5 і 16 для МОР MACCE) було обрано 5 змінних для МОР BARC-2/3/5 і 11 змінних – для МОР MACCE. Отже, багатопараметрична модель прогнозування кровотеч BARC-2/3/5 містила такі предиктори, як вихідний рівень гемоглобіну, лікування інгібіторами протонної помпи (ІПП), вік, захворювання печінки й активне куріння, а модель прогнозування MACCE – такі предиктори, як проведення ЧКВ в умовах тропонін-позитивного гострого коронарного синдрому (ГКС), аорто-коронарне шунтування в анамнезі, цукровий діабет (ЦД), ЧКВ в анамнезі, захворювання периферичних артерій, активне куріння, літній вік, застійна серцева недостатність в анамнезі, ІМ в анамнезі, складне ЧКВ і вихідна розрахункова швидкість клубочкової фільтрації <60 мл/хв/1,73 м2 (фактори ризику наведені в порядку зменшення сили зв'язку). Досліджуване лікування (стандартна ПАТ vs монотерапія тикагрелором) зберігало функцію значущого предиктора кровотеч після коригування за п'ятьма вихідними змінними МОР BARC-2/3/5. Розподіл відібраних факторів ризику на вихідному рівні в досліджуваній вибірці загалом і з групуванням залежно від наявності ішемічних або геморагічних подій протягом року спостереження наведено в таблиці 1 [13]. Аналіз розподілу факторів ризику на вихідному рівні показав, що середній вік учасників становив 64 роки, приблизно чверть із них були активними курцями, майже половина учасників раніше перенесли ЧКВ, у 37% був ЦД, а 29% раніше перенесли ІМ [13].
З урахуванням двох отриманих оцінок (для ішемічного й геморагічного ризиків) усіх пацієнтів розподілили за терцилями (нижній, середній, високий) шкал ризиків BARC-2/3/5 і MACCE. У кожному терцилі, що містив приблизно 2300 пацієнтів, спостерігали добру узгодженість між прогнозованими й спостережуваними ризиками, вираженими у вигляді відносної (відсоток) кількості подій (BARC-2/3/5 і MACCE) через рік лікування, що підтверджує добре калібрування моделей [13]. При порівнянні верхнього й нижнього терцилів шкал ризику спостережувана частота подій становила 7,8 vs 3,7% для BARC-2/3/5 і 6,8 vs 1,2% для MACCE відповідно. У моделі прогнозування кровотеч спостерігався помірний (0,64) показник дискримінації, що відображає приблизно 2-кратну різницю в ризиках між верхнім і двома нижніми терцилями (збільшення річного ризику з 4,3 до 7,9%, відношення ризиків [ВP] 1,86, 95% довірчий інтервал [ДІ] 1,53–2,27, р<0,001). Показник дискримінації в моделі прогнозування ішемічних подій був вищим (0,71), відображаючи деяку різницю в ризиках між нижнім і середнім терцилями і виражену різницю між верхнім терцилем шкали порівняно з двома нижніми терцилями (майже 3-кратне збільшення річного ризику з 2,1 до 6,9%; ВР 3,42, 95% ДІ 2,66–4,40, р<0,0001). Отже, подальший аналіз даних із дослідження TWILIGHT був сфокусований на порівнянні результатів лікування в підгрупі пацієнтів із верхнього терциля (категорія «високий ризик») із підгрупою пацієнтів із двох нижніх терцилів (категорія «низький ризик») спочатку для геморагічного, а потім – для ішемічного ризику [13].
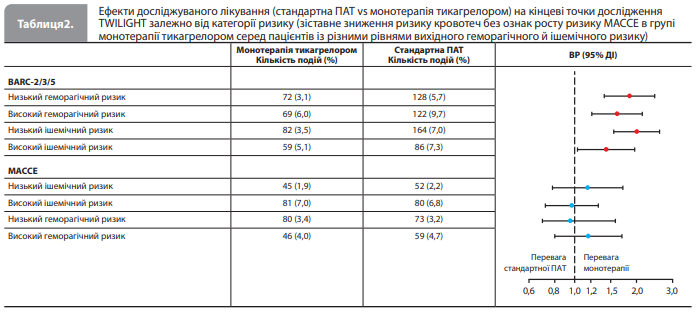
Оцінка ефектів досліджуваної терапії з урахуванням категорій ризику кровотеч та ішемічних подій. Відносний ефект стандартної ПАТ порівняно з монотерапією тикагрелором на ризик BARC-2/3/5 не залежав від вихідного ризику кровотеч і був зіставним у підгрупах пацієнтів із низьким і високим геморагічним ризиком (ВР 1,85, 95% ДІ 1,40–2,46 і ВР 1,61, 95% ДІ 1,21–2,14 відповідно; р для взаємодії 0,54) (табл. 2). Такий самий висновок було зроблено під час порівняння ефектів досліджуваної терапії на ризик BARC-2/3/5 у підгрупах пацієнтів із низьким і високим ризиком ішемічних подій (ВР 2,01, 95% ДІ 1,55–2,60 і ВР 1,43, 95% ДІ 1,04–1,96 відповідно; р для взаємодії 0,11) (табл. 2) [13]. При порівнянні абсолютних ризиків кровотечі було отримано схожі результати, хоча й відзначено чисельно вищий надлишковий геморагічний ризик, пов'язаний зі стандартною ПАТ, у пацієнтів із підгрупи високого геморагічного ризику. Слід зазначити, що частота кровотеч BARC-2/3/5 у підгрупах низького й високого геморагічного ризику не залежала від вихідного ризику ішемічних подій у пацієнтів із цих підгруп (р для взаємодії 0,24). Ефекти досліджуваної терапії (стандартна ПАТ vs монотерапія тикагрелором) на ризик МАССЕ не залежали від індивідуального геморагічного або ішемічного ризику (р для взаємодії 0,42 і 0,47 відповідно) (табл. 2). Крім того, частота МАССЕ в підгрупах високого й низького ішемічного ризику не залежала від ризику кровотечі у пацієнтів із цих підгруп (р для взаємодії 0,14) [13].
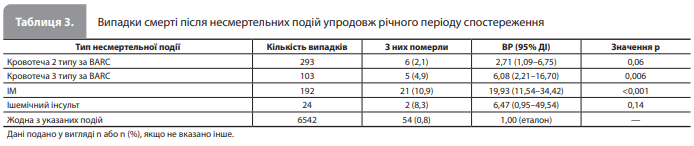
Вплив несмертельних кровотеч та ішемічних подій на смертність від будь-яких причин. Протягом року спостереження після рандомізації померли загалом 82 (1,2%) із 7119 пацієнтів. У таблиці 3 показано кількість смертей, що сталися після певних різновидів несмертельних геморагічних та ішемічних подій [13]. Серед несмертельних подій, що розвинулися на тлі досліджуваного лікування, найбільший внесок у ризик подальшої смерті вніс ІМ: рівень смертності становив 10,9% серед пацієнтів після ІМ, 8,3% – після ішемічних інсультів, 4,9% – після кровотечі 3 типу за BARC і 2,1% – після кровотечі 2 типу за BARC. Автори зазначили, що хоча кровотеча BARC-2/3 була пов'язана з підвищенням ризику смерті від будь-яких причин під час подальшого спостереження (ВР 2,71, 95% ДІ 1,09–6,75, р=0,06 і ВР 6,08, 95% ДІ 2,21–16,70, р=0,006 для кровотеч 2 й 3 типу за BARC відповідно), однак ризик смерті після несмертельної ішемічної події був набагато вищим (ВР 19,93, 95% ДІ 11,54–34,42, р<0,001 і ВР 6,47, 95% ДІ 0,95–49,54, р=0,14 для ІМ та ішемічного інсульту відповідно) [13].
Обговорення результатів аналізу Mendieta et al. Першим етапом дослідження Mendieta et al. була розробка двох прогностичних моделей для оцінки річного ризику кровотеч (BARC-2/3/5) та ішемічних подій (MACCE) у пацієнтів, які пройшли ЧКВ і отримали 3-місячну ПАТ на основі тикагрелору. Результати подальшого аналізу даних із дослідження TWILIGHT, проведеного в підгрупах пацієнтів високого й низького ішемічного та геморагічного ризиків, виділених із використанням розроблених моделей, підтверджують користь раннього скасування АСК (по завершенні 3-місячної ПАТ, призначеної у зв'язку з ЧКВ) для пацієнтів із будь-яким (вищим і нижчим) вихідним ризиком кровотеч. Зниження частоти кровотеч при використанні монотерапії тикагрелором порівняно зі стандартною ПАТ було послідовним і не залежало від вихідних (після 3-місячної ПАТ) ризиків кровотечі (р для взаємодії 0,54) та ішемічних подій (р для взаємодії 0,11) [13]. Важливо, що ця перевага монотерапії тикагрелором не компенсувалася збільшенням ризику MACCE, незалежно від вихідного рівня ризику кровотечі чи ішемії (табл. 2). Mendieta et al. уперше провели індивідуальну оцінку ризику в окремих пацієнтів для аналізу ефективності й безпечності монотерапії тикагрелором порівняно зі стандартною ПАТ шляхом одночасного моделювання потенційних переваг (зниження ризику кровотеч) і потенційних недоліків (підвищення ризику ішемії) раннього скасування АСК [13]. Аналіз подій МАССЕ показав відсутність відмінностей між наслідками переходу на монотерапію тикагрелором у підгрупах із різним вихідним рівнем ішемічного ризику. Разом із даними з аналізів у підгрупах учасників TWILIGHT, які пройшли складне ЧКВ, та учасників із ЦД [15, 16], які показали, що результат лікування в пацієнтів із дуже високим ішемічним ризиком відповідає такому в загальній досліджуваній вибірці, результати дослідження Mendieta et al. підтверджують безпеку раннього (після 3-місячної ПАТ) скасування АСК у пацієнтів із підвищеним ризиком MACCE, які раніше перенесли ЧКВ [13]. Аналіз випадків розвитку BARC-2/3/5 на тлі монотерапії тикагрелором за різного вихідного рівня геморагічного ризику показав, що абсолютна користь від переходу на монотерапію тикагрелором після 3 місяців ПАТ є дещо більшою в пацієнтів із високим вихідним ризиком кровотечі порівняно з пацієнтами з нижчим ризиком. Крім того, було показано, що зв'язок між вихідним індивідуальним рівнем ризику кровотечі й частотою розвитку кровотеч BARC-2/3/5 на тлі лікування не залежав від індивідуального рівня ішемічного ризику пацієнта, і це узгоджується з попередніми літературними даними, згідно з якими під час ухвалення рішення щодо зменшення інтенсивності антиагрегантного ефекту шляхом скорочення тривалості ПАТ ризик кровотечі є важливішим, ніж ризик ішемії [17]. Отже, результати Mendieta et al. показали, що користь від раннього скасування АСК у вигляді запобігання кровотечі досягається як за високого, так і за низького вихідного ризику кровотечі й не компенсується зростанням частоти ішемічних подій, незалежно від категорії геморагічного та/або ішемічного ризику на вихідному рівні [13]. Оцінка внеску несмертельних геморагічних та ішемічних подій, що розвинулися на тлі лікування, у ризик подальшої смерті від будь-яких причин показав, що, хоча в пацієнтів після ЧКВ кровотеча, безсумнівно, є предиктором небажаних явищ [8], для загальної смертності ішемічні події, що сталися після ЧКВ, мають істотно більше значення. Тобто, і несмертельна кровотеча, і несмертельний ІМ/інсульт були пов'язані з вищим ризиком подальшої смерті від будь-яких причин, однак цей ризик був набагато вищим, якщо несмертельна подія була ішемічною. При інтерпретації цього висновку слід додатково враховувати доволі низьку частоту небажаних подій у TWILIGHT, що частково пояснюється недопущенням до рандомізації пацієнтів із великою кровотечею та/або ішемічною подією впродовж перших 3 місяців після індексного ЧКВ (період перед рандомізацією, коли всі пацієнти отримували ПАТ). Загалом той факт, що в пацієнтів, які перенесли ЧКВ, продовження застосування АСК після завершення 3-місячної ПАТ не забезпечує кращого захисту від ішемії, але пов'язане з вищим ризиком кровотеч, додатково підтверджує безпеку монотерапії тикагрелором із погляду впливу на смертність від будь-яких причин [13]. Mendieta et al. визнають, що розроблені ними моделі й подальший аналіз мають низку обмежень, пов'язаних, наприклад, із дизайном і правилами відбору учасників у дослідження TWILIGHT, наголошують, що отримані результати можна застосувати лише до осіб, які відповідають критеріям включення до TWILIGHT, і закликають до подальшої перевірки своїх прогностичних моделей серед пацієнтів з іншими факторами високого ризику, що перенесли ЧКВ [13].
Висновки Отже, новий аналіз результатів дослідження TWILIGHT із використанням моделей оцінки індивідуального ризику кровотеч та ішемічних подій засвідчив, що в пацієнтів після ЧКВ скасування АСК після 3-місячної ПАТ комбінацією АСК + тикагрелор порівняно з продовженням ПАТ знижує частоту розвитку кровотеч як за вищого, так і за нижчого вихідного геморагічного ризику, не підвищуючи при цьому ризику ішемічних подій.
Список літератури знаходиться в редакції
Автор огляду Олена Грибова Medicine Review 2023; 5 (72): 5 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |