Раннє й інтенсивне зниження рівня ХС ЛПНЩ - нова стратегія гіполіпідемічної терапії для пацієнтів із гострими коронарними синдромами: огляд консенсусного документа ESC (2022)Пацієнти, які перенесли гострий коронарний синдром (ГКС), схильні до високого ризику повторних серцево-судинних (СС) подій, особливо протягом першого року після виписки зі стаціонару. Водночас переконливо доведена наявність чіткої асоціації між рівнем холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) і ризиком розвитку атеросклеротичних СС захворювань (АССЗ) зі зниженням ризику АССЗ пропорційно абсолютному зниженню рівня ХС ЛПНЩ. У зв'язку з цим у настанові Європейської кардіологічної асоціації (ESC)/Європейського товариства атеросклерозу (EAS) щодо лікування дисліпідемій (2019) і настанові ESC щодо лікування ГКС без підйому сегмента ST (ГКСбпST; 2020) для корекції дисліпідемії рекомендується проводити поетапну гіполіпідемічну терапію (ГЛТ) із повторними оцінками рівнів ХС ЛПНЩ через кожні 4–6 тижнів, а всім пацієнтам після ГКС, незалежно від вихідних рівнів ХС ЛПНЩ, рекомендується призначати високоінтенсивну (ВІ) терапію статинами й прагнути досягнення рівня ХС ЛПНЩ <55 мг/дл (<1,4 ммоль/л) та зниження показника не менше ніж на 50% від вихідного рівня. Якщо ці цілі недосяжні при використанні тільки ВІ монотерапії статинами, рекомендується додати езетиміб, а за неефективності подвійної ГЛТ – інгібітор пропротеїн конвертази субітилізин/кексин типу 9 (іPCSK9). У пацієнтів з АССЗ і другою ішемічною подією, що розвинулася на тлі максимальної переносимої статинотерапії, рекомендований цільовий рівень ХС ЛПНЩ знижується до <40 мг/дл (<1,0 ммоль/л). Настанова ESC 2021 року з профілактики АССЗ також рекомендує поетапний підхід до досягнення цілей зі зниження рівня ХС ЛПНЩ, зокрема в пацієнтів зі встановленим АССЗ, з початковою метою <70 мг/дл (1,8 ммоль/л) і подальшим зниженням цільового показника до <55 мг/дл (<1,4 ммоль/л). Проте алгоритм ГЛТ, запропонований у сучасних настановах ESC, э однаковим для пацієнтів зі стабільною АССЗ і хворих на ранній стадії після ГКС, незважаючи на значні відмінності в рівнях ризику. Слід зазначити, що ступінь зниження сироваткової концентрації ХС ЛПНЩ у відповідь на фармакологічні втручання є передбачуваним і залежить від вихідного рівня ХС ЛПНЩ, і в результаті можна припустити, що значна частина пацієнтів із ГКС не досягне цільових значень показника, якщо під час виписки їм призначена лише ВІ статинотерапія. Це припущення підтверджують спостережні дані, які вказують на низьку частоту призначення додаткових ліпідознижувальних препаратів і рідкісну корекцію дози після виписки зі стаціонару, що призводить до недосягнення поставлених цілей у більшості пацієнтів після ГКС. Серед причин вказують терапевтичну інертність лікарів, системні бар'єри, а також недотримання пацієнтами графіка візитів до фахівця й повну втрату зв'язку з багатьма хворими після виписки зі стаціонару. Однак навіть в ідеальному випадку при дотриманні рекомендованого поетапного підходу до ГЛТ пацієнтам після ГКС може знадобитися до 12 тижнів для досягнення оптимального рівня ХС ЛПНЩ, що, наприклад, для постінфарктних пацієнтів, відповідає найвразливішому періоду відновлення після великої коронарної події, а саме першим 100 дням, упродовж яких, за даними обсерваційних досліджень, частота ішемічних подій, включно з інфарктом міокарда (ІМ), інсультом або СС смертю, становить 10%. На думку європейських експертів, кращі результати при нижчих значеннях ХС ЛПНЩ у рандомізованих клінічних дослідженнях (РКД), а також останні дані щодо зменшення розмірів і покращення складу атеросклеротичних бляшок у відповідь на швидке та сильне зниження рівня ХС ЛПНЩ у пацієнтів після ГКС обґрунтовують проведення ранньої інтенсивної комбінованої ГЛТ у цієї категорії хворих. Минулого року експерти Європейської асоціації превентивної кардіології (ЕАРС) спільно з робочою групою ESC з фармакотерапії АССЗ опублікували консенсусний документ, у якому наводять аргументацію на користь застосування цього підходу, а також розглядають доступні лікарські препарати, що підходять для його реалізації [1].
Обґрунтування користі від сильного й швидкого зниження рівня ХС ЛПНЩ після ГКС Як відомо, тромбоцити, моноцити й ліпіди поряд з ендотеліоцитами (точніше – ендотеліальною дисфункцією) є основними учасниками атерогенезу, що веде до атеросклеротичного ураження коронарних артерій. Локальне розростання атеросклеротичних бляшок за рахунок ліпідного ядра, що включає ліпідовмісні пінисті клітини й детрит, який утворюється в результаті апоптозу клітин, може призвести до дестабілізації та розриву бляшки, виходу в кровообіг її високо прокоагулянтного вмісту з подальшою тромботичною оклюзією судин і розвитком ІМ. За стабілізацію бляшки відповідає фіброзна покришка, що покриває бляшку з боку просвіту судини. За останні десятиліття підвищення якості первинної СС профілактики, включно з використанням ГЛТ, привело до зміщення основної причини ГКС від розриву бляшок до їх поверхневої ерозії. Хоча механізм поверхневої ерозії бляшки до кінця не вивчений, припускають, що основну роль відіграє взаємодія матриксних металопротеаз, компонентів вродженої імунної системи, нейтрофілів і активованих тромбоцитів. Цікаво, що рівень ХС ЛПНЩ нещодавно був пов'язаний із кількістю та прозапальною активністю циркулюючих моноцитів, що посилює відому асоціацію між високим рівнем ХС ЛПНЩ і прогресуванням АССЗ. Зокрема, було показано, що моноцити пацієнтів із сімейною гіперхолестеринемією (СГХ) вирізняються підвищеною експресією рецептора, необхідного для проникнення в атеросклеротичні бляшки, який також є важливим для типової послідовної екстравазації цих клітин в інфарктну тканину при ІМ. Слід зазначити, що лікування іPCSK9 знижує вміст ХС у моноцитах, змінює їхній прозапальний статус і зменшує міграційний потенціал, що ще раз підтверджує наявність зв'язку між підвищеним рівнем циркулюючого ХС, активацією запалення й прогресуванням АССЗ. У клінічних дослідженнях чіткий зв'язок між інтенсивною ГЛТ і поліпшенням результатів після ГКС уперше був продемонстрований майже два десятиліття тому. А нещодавно було описано спостережуване на тлі ГЛТ лінійне зниження кількості несприятливих СС подій, яке тривало навіть при зменшенні концентрації ХС ЛПНЩ нижче від рекомендованих сьогодні цільових рівнів, що підтримує дискусію про доцільність досягнення нижчих цілей у пацієнтів після ГКС. Додаткові дані на користь розглянутого підходу отримали у двох нещодавніх (2022) РКД, які вивчали ефект дуже раннього додавання іPCSK9 алірокумабу або еволокумабу до стандартної ГЛТ у пацієнтів із ГКС, черезшкірним коронарним втручанням (ЧКВ) на інфаркт-зв'язаній артерії (ІЗА) та ангіографічними ознаками незначного атеросклерозу поза ІЗА. Через рік спостереження було відзначено значне поліпшення первинних кінцевих точок – мінімальної товщини фіброзної покришки й об'єму атероми – поза ІЗА в пацієнтів, які отримували іPCSK9 на додаток до стандартної ГЛТ. Важливо підкреслити, що в цих дослідженнях іPCSK9 модифікували перебіг АССЗ не через зупинку прогресування, а через регрес коронарного атеросклерозу. На відміну від груп експериментальної комбінованої терапії (стандартна ГЛТ + іPCSK9), більшість пацієнтів у контрольних групах, які отримували тільки стандартну ГЛТ, не досягли цільового рівня ХС ЛПНЩ. В обох дослідженнях (хоча і в ретроспективних аналізах) було продемонстровано чіткий зв'язок між досягнутим рівнем ХС ЛПНЩ і покращенням фенотипу атероми. Отримані результати свідчать про те, що раннє інгібування PCSK9 у хворих на ГКС є безпечним, досяжнім і забезпечує стабілізацію атером, що може запобігти їхньому розриву й повторному розвитку ГКС. Нижче розглядаються препарати та комбінації препаратів із різною ефективністю й швидкістю розвитку ефекту, які потенційно підходять для раннього та сильного зниження рівня ХС ЛПНЩ після ГКС.
Препарати для ГЛТ: фармакодинамічний профіль, ефективність і безпечність У більшості проведених досліджень гіполіпідемічних препаратів (ГЛП) основна увага приділялася величині ефекту, а не швидкості зниження рівня ХС ЛПНЩ. Однак, з огляду на високий ризик повторних подій у найближчі тижні та місяці після перенесеного ГКС, швидкість зниження рівня ХС ЛПНЩ стала новим предметом підвищеної уваги. У таблиці 1 представлені узагальнені дані про величину ефекту різних ГЛП на рівні ХС ЛПНЩ, а також про результати перших 2 тижнів терапії.
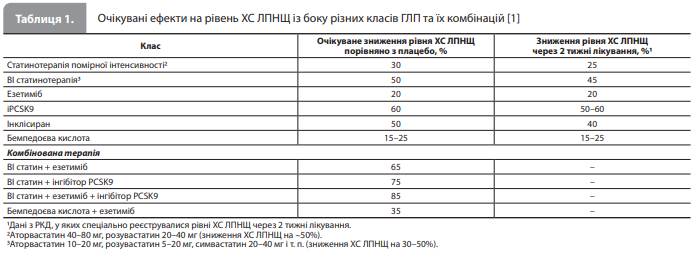
Концепцію гострого зниження рівня ХС ЛПНЩ оцінювали в трьох невеликих дослідженнях із призначенням іPCSK9 у гострій фазі ГКС, які продемонстрували безпечність, доцільність і ефективність такого підходу. Зокрема, у дослідженні EVACS (n=57) значне зниження рівня ХС ЛПНЩ спостерігали вже за 24 год після введення першої дози еволокумабу, а на час виписки зі стаціонару (приблизно на 4-й день після розвитку ГКС) рекомендованого настановами рівня ХС ЛПНЩ <55 мг/дл (<1,4 ммоль/л) досягли дві третини пацієнтів. Максимальний ефект лікування спостерігався на 4–7-й день: у цей день у групі іPCSK9 рівень ХС ЛПНЩ був приблизно на 50% нижчим, ніж у групі стандартної терапії. У більшому дослідженні еволокумабу (EVOPACS, n=308, застосування еволокумабу розпочинали під час госпіталізації з приводу ГКС) частота досягнення цільового рівня ХС ЛПНЩ за 8 тижнів після перенесеного ГКС становила 90% у групі еволокумабу порівняно з 11% у групі стандартної терапії. В аналогічному дослідженні з початком застосування алірокумабу протягом 24 год після розвитку ІМ без підйому сегмента ST (VCU-AlirocRT, n=20) значне зниження рівня ХС ЛПНЩ спостерігалося вже на третій день, а дуже виражене зниження середнього рівня ХС ЛПНЩ до 28 мг/дл (0,72 ммоль/л) – через 14 днів після початку лікування. Новий ГЛП інклісиран (мала інтерферуюча РНК, що інгібує трансляцію білка PCSK9) знижує рівень ХС ЛПНЩ на ~50%. За даними досліджень, приблизно через 14 днів після першої ін’єкції досягається зниження рівня ХС ЛПНЩ на 40%, максимальне зниження (50%) спостерігалося приблизно через 30 днів. При використанні дводозової схеми із введенням другої ін'єкції через 90 днів після першої досягається дещо більш виражений ефект. Під час обговорення безпеки стратегії швидкого й сильного зниження рівня ХС ЛПНЩ слід згадати думку про те, що агресивне зниження цього різновиду ХС може сприяти розвитку геморагічного інсульту. Ця думка наразі не доведена, більше того, у попередньому аналізі даних дослідження ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab) частота геморагічного інсульту після ГКС була незначною та не збільшувалася при застосуванні алірокумабу порівняно з плацебо. Слід, однак, зазначити, що рандомізацію в цьому дослідженні проводили в середньому через 2,6 місяця після ГКС, тобто після завершення критичного перипроцедурного періоду, під час якого розвивається більшість крововиливів/кровотеч. Водночас у нещодавньому метааналізі, що включив дані 11 досліджень за участю більш ніж 20 тис. пацієнтів, у яких порівнювали результати більш і менш інтенсивного зниження рівня ХС ЛПНЩ після ішемічного інсульту, інтенсивніше зниження ХС ЛПНЩ було пов'язане з підвищенням ризику геморагічного інсульту разом зі зниженням частоти повторного інсульту й великих несприятливих СС подій (МАСЕ). При оцінці перспектив інтенсивнішого зниження ХС ЛПНЩ показник number needed to treat (індекс потенційної користі) вказував на необхідність пролікувати 90 осіб для профілактики одного повторного інсульту і 35 осіб – для профілактики MACE, а показник number needed to harm (індекс потенційної шкоди) – на те, що для розвитку одного геморагічного інсульту лікування мають отримати 242 особи. Зіставивши ці дані, автори дійшли висновку, що співвідношення «користь/ризик» за інтенсивнішого зниження рівня ХС ЛПНЩ загалом може бути більш сприятливим, ніж при менш інтенсивному зниженні ХС ЛПНЩ, особливо в пацієнтів з атеросклеротичною хворобою. Інших сигналів про шкідливі ефекти, спричинені раннім і сильнішим зниженням рівня ліпідів під час ГКС порівняно зі стандартною ГЛТ, на сьогодні не виявлено. Отже, з огляду на те, що повторні ішемічні події після ГКС часто відбуваються протягом 1–3 місяців після першої коронарної катастрофи і що рання стабілізація атероми може бути важлива для вторинної профілактики СС подій, стратегія раннього й сильного зниження ХС ЛПНЩ із застосуванням оптимальної комбінації ефективних і безпечних ГЛП може бути корисною та потребує подальшого вивчення.
Вплив раннього та/або сильного зниження ХС ЛПНЩ після ГКС на клінічні наслідки Переваги сильного зниження рівня ХС ЛПНЩ. Найпереконливіші докази поліпшення результатів лікування внаслідок сильного зниження рівня ХС ЛПНЩ після ГКС отримано в дослідженні MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering, n=3086), у якому терапію аторвастатином у дозі 80 мг/добу, що розпочалася через 1–4 дні після госпіталізації та тривала 4 місяці, порівнювали з плацебо. У цьому дослідженні лікування аторвастатином значно знизило як рівень ХС ЛПНЩ (72 vs 135 мг/дл), так і ризик MACE (на 16%;відношення ризиків [ВР] 0,84, 95% довірчий інтервал [ДІ] 0,70–1,00), причому криві подій для груп аторвастатину й плацебо розходились уже через 4 тижні терапії. Разом із цим, у дослідженні PROVE-IT ТIMI-22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy, n=4162), яке порівнювало ефекти 2-річної (медіана) терапії аторвастатином 80 мг/добу й правастатином 40 мг/добу за умови початку лікування впродовж 10 днів після ГКС, аторвастатин 80 мг/добу значно знизив ризик MACE (зниження ризику на 16%, р=0,005) порівняно з правастатином, причому клінічний ефект став очевидним уже через 4 місяці лікування. За останнє десятиліття у двох дослідженнях було продемонстровано зниження ризику несприятливих СС подій після ГКС у разі використання нестатинової ГЛТ на додаток до статинів. Так, у дослідженні IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) порівнювали езетиміб 10 мг/добу і плацебо при додаванні кожного з них до симвастатину в дозі 40–80 мг/добу протягом 10 днів після перенесеного ГКС. Переваги езетимібу почали проявлятися через рік лікування, а через 6 років було відзначено значне зниження відносного ризику MACE на 6% (ВР 0,84, 95% ДІ 0,89–0,99). У дослідженні ODYSSEY OUTCOMES іPCSK9 алірокумаб порівнювали з плацебо в пацієнтів із рівнем ХС ЛПНЩ >70 мг/дл на тлі стабільної ВІ статинотерапії через 1–12 міс після ГКС (медіана часу від розвитку ГКС до рандомізації становила 2,6 місяця). Алірокумаб знижував частоту MACE порівняно з плацебо (зниження відносного ризику на 15%), причому ефективність ставала очевидною через ~1 рік лікування. Слід зазначити, що цільовий рівень ХС ЛПНЩ у цьому дослідженні становив 25–50 мг/дл, тобто був нижчим за рекомендований, і доза алірокумабу була скоригована відповідним чином. Важливо, що нещодавно опубліковані результати більш тривалого (до 5 років) спостереження в цьому РКД узгоджуються з результатами основного дослідження з точки зору ефективності, безпечності й переносимості терапії. Важливість якомога більш раннього інтенсивного зниження рівня ХС ЛПНЩ у пацієнтів після ІМ підтверджують результати вторинного аналізу й додаткового відкритого дослідження, проведених у рамках РКД FOURIER (Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk). Серед учасників основного дослідження (27 564 осіб з АССЗ, які отримували статинотерапію й яких, згідно з протоколом дослідження, рандомізували на лікування еволокумабом або плацебо), 22 320 перенесли ІМ, залежно від давності якого було виділено підгрупи нещодавнього (менш ніж за 12 місяців до рандомізації) і давнього (більш ніж за 12 місяців до рандомізації) ІМ. Вторинний аналіз показав, що у пацієнтів, які нещодавно перенесли ІМ, частота несприятливих СС подій була вищою, а терапія еволокумабом асоціювалася зі значнішим зниженням ризику первинної комбінованої кінцевої точки (комбінація СС смерті, ІМ, інсульту, коронарної реваскуляризації та госпіталізації з приводу нестабільної стенокардії) порівняно з пацієнтами з давнім ІМ (зниження на 19 vs 8% відповідно). У додатковому відкритому дослідженні з медіаною спостереження 5 років понад 3000 пацієнтів, які в основному дослідженні FOURIER отримували плацебо, були переведені на еволокумаб, і їхні результати порівняли з результатами аналогічної за чисельністю групи, що складалася з пацієнтів, які продовжували лікування еволокумабом, розпочате в основному дослідженні FOURIER. У групі, яка продовжувала отримувати еволокумаб, ризик СС смерті, ІМ або інсульту був нижчим на 20%, порівняно з групою пацієнтів, переведених із плацебо на еволокумаб, що переконливо свідчить про важливість ранньої та ефективної ГЛТ. Переваги раннього зниження рівня ХС ЛПНЩ. Доказова база на підтримку раннього й швидкого зниження рівня ХС ЛПНЩ за допомогою потужної ГЛТ в умовах ГКС досить обмежена. Так, плацебо-контрольоване дослідження SECURE PCI (Statins Evaluation in Coronary Procedures and Revascularization) не підтвердило клінічної переваги перипроцедурного приймання двох навантажувальних доз (80 мг) аторвастатину в пацієнтів із ГКС і передбачуваним інвазивним лікуванням. Однак у заздалегідь запланованій підгрупі пацієнтів, які пройшли ЧКВ (65% усіх учасників дослідження), інтенсивна терапія аторвастатином значно знизила ризик MACE на 28%, тоді як у підгрупі пацієнтів, які не проходили ЧКВ, спостерігалася тенденція до збільшення ризику MACE (р для взаємодії 0,02). Ці дані дають змогу лише сформулювати гіпотезу, тому потрібні додаткові дослідження. Позитивний ефект високої дози аторвастатину, який спостерігали в групі ЧКВ, зберігався незалежно від точного часу допроцедурного приймання препарату (упродовж двох годин перед ЧКВ), що дає змогу припустити наявність у високої дози аторвастатину додаткових захисних ефектів, не пов’язаних зі зниженням рівня ХС ЛПНЩ. Схожі результати були отримані в метааналізі, що включив РКД, проведені до SECURE PCI, і показав, що у пацієнтів з ГКС допроцедурне (але не постпроцедурне) приймання статинів значно знижує 30-денну частоту ІМ на 62% порівняно з відсутністю статинів або прийманням низьких доз статинів. Дані 300 тис. пацієнтів із національного регістра США підтвердили, що раннє (протягом 24 год) приймання статинів як нової або продовження раніше призначеної терапії після розвитку гострого ІМ асоціюється з помітним зниженням внутрішньолікарняної смертності (4,0% і 5,3% порівняно з 15,4% за відсутності лікування статинами протягом перших 24 год відповідно). Раннє застосування статинів після ГКС також асоціювалося з меншою частотою кардіогенного шоку, аритмій, зупинки й розриву серця. Нещодавно опубліковані 4-річні спостережні дані з Кореї підтверджують, що призначення статинів протягом 24 год після госпіталізації з приводу гострого ІМ пов'язане зі зниженням частоти MACE на 22%. Представлені, нехай і обмежені, дані свідчать про те, що дуже ранній (до ЧКВ) початок високоінтенсивної терапії статинами може бути корисним. Також початок застосування іPCSK9 на госпітальному етапі забезпечує досягнення цільового рівня ХС ЛПНЩ у більшості пацієнтів у найвразливішому періоді – у перші тижні після ГКС. Чи буде зниження рівня ХС ЛПНЩ за допомогою іPCSK9 сприяти зменшенню ризику несприятливих СС подій у гострому періоді після ГКС, необхідно перевірити у спеціальних дослідженнях. Раннє сильне зниження рівня ХС ЛПНЩ зі швидким досягненням цільових значень. У великому спостережному дослідженні, проведеному у Швеції серед 40 607 пацієнтів з нещодавно перенесеним гострим ІМ, оцінювали зв'язок між ризиком СС подій і зміною рівня ХС ЛПНЩ за період від індексної події до амбулаторного візиту через 6–10 тижнів після неї. У результаті майже 4-річного спостереження (медіана спостереження 3,78 року) було виявлено, що значне (на >50%) і раннє зниження рівня ХС ЛПНЩ на тлі застосування ВІ статинів пов'язане зі зниженням ризику всіх СС подій порівняно з прийманням нижчих доз статинів. У зв'язку з цим важливо відзначити неодноразово зареєстровану в різних регіонах світу низьку частоту призначення додаткових ГЛП і коригувань дози ГЛП у пацієнтів з ГКС і стабільними АССЗ після виписки зі стаціонару, що ще раз підкреслює важливість внутрішньолікарняного початку ВІ ГЛТ для досягнення рекомендованих рівнів ХС ЛПНЩ і, потенційно, зниження ризику СС подій. Основні проблеми, що перешкоджають досягненню цільових показників ліпідного профілю в клінічній практиці. Основні бар’єри, що перешкоджають досягненню цілей зі зниження ХС ЛПНЩ після ГКС, можна розділити на пов’язані з лікарями, системою охорони здоров’я і пацієнтами (табл. 2).

Призначення неадекватної ГЛТ при виписці зі стаціонару є звичайним явищем. Наприклад, у дослідженні EUROASPIRE V високоінтенсивна ГЛТ під час виписки була призначена лише половині пацієнтів, а в більш пізньому дослідженні DA VINCI частка пацієнтів зі встановленим АССЗ, а, отже, і з дуже високим СС ризиком, які отримували ВІ монотерапію статином, терапію комбінацією статин + езетиміб або статин + іPCSK9, становила 36,7%, 9% і 1,2% відповідно. Така ситуація може бути пов'язана з інертністю лікарів, недотриманням рекомендацій та адміністративними бар'єрами при призначенні ГЛТ. Після виписки зі стаціонару обмежений доступ до програм кардіологічної реабілітації та/ або відсутність структурованої програми ведення пацієнта можуть призвести до порушення координації між медичними працівниками, запізнілої повторної оцінки ліпідного профілю й втрати зв'язку з пацієнтом, що знижує шанси на оптимальну вторинну профілактику СС подій. Низька прихильність є серйозною проблемою для будьякої довгострокової терапії, включно з ГЛТ, оскільки при вторинній СС профілактиці зниження ризику значною мірою залежить від дотримання призначеної лікарем схеми приймання лікарських препаратів. Останніми роками визнається, що розширення прав і можливостей пацієнтів у вигляді отримання більшого контролю над рішеннями й діями, що впливають на їхнє здоров'я, вкрай важливе для підвищення прихильності. Лікарі мають сприяти навчанню пацієнтів під час госпіталізації та подальшого спостереження через ефективну комунікацію й поширення освітніх матеріалів у різних форматах (буклети, навчальні відеоматеріали, сайти лікарень і наукових товариств). Крім того, необхідно проводити освітні заходи для лікарів і людей, які доглядають за пацієнтами після ГКС, з акцентом на доказових даних і клінічних рекомендаціях, а також на ефективних стратегіях підвищення прихильності до лікування. Доступність непатентованих комбінованих препаратів (ВІ статин + езетиміб), а також схеми лікування новими ГЛП із великими інтервалами між ін'єкціями (один або два рази на місяць для іPCSK9 і два рази на рік – для інклісирану) можуть додатково підвищити прихильність до лікування та, врешті-решт, поліпшити його результати.
Оптимальний підхід до зниження ХС ЛПНЩ після ГКС Індивідуальний підхід до ГЛТ у гострому періоді ГКС. Автори консенсусного документа пропонують такий алгоритм корекції ліпідного профілю після ГКС (рис.). Насамперед, якомога раніше після госпіталізації хворого з ГКС необхідно оцінити ліпідний профіль пацієнта (ліпідна панель, кров беруть не натщесерце). Крім стандартних показників рекомендується визначити рівень ліпопротеїну(а), якщо такий аналіз не проводився раніше. Усі пацієнти повинні отримувати ВІ статинотерапію (тобто з очікуваним зниженням рівня ХС ЛПНЩ на >50%, наприклад, терапію аторвастатином у дозі 40–80 мг/добу або розувастатином у дозі 20–40 мг/добу) з початком лікування до коронарної ангіографії та до отримання результатів аналізу ліпідного профілю. Якщо пацієнт уже отримує статини, принципово важливо не переривати ВІ статинотерапію або (якщо хворий отримує низько- чи середньоінтенсивну ГЛТ) одразу перевести пацієнта на високоінтенсивний варіант терапії.

На додаток до ВІ статинотерапії доцільним вважається призначення езетимібу в ранні терміни після ГКС, незалежно від рівня ХС ЛПНЩ на тлі приймання статинів, з огляду на добру переносимість езетимібу при призначенні в ранні терміни після ГКС і його клінічний ефект, який пояснюється зниженням рівня ХС ЛПНЩ. Доведений лінійний зв'язок між досягнутим рівнем ХС ЛПНЩ і ризиком СС подій, відсутність проблем із безпекою, дані про низьку частоту інтенсифікації ГЛТ після виписки зі стаціонару в реальній практиці, висока частота повторних СС подій у перші тижні й місяці після ГКС, а також доступність непатентованого езетимібу у вигляді монопрепаратів та комбінацій з ВІ статином обґрунтовують призначення кожному хворому із ГКС комбінації езетиміб + ВІ статин під час виписки зі стаціонару. Найбільшу користь від такого раннього призначення комбінованої ГЛТ отримають пацієнти з вихідним рівнем ХС ЛПНЩ >100 мг/дл, у яких, як очікують, навіть ВІ статинотерапії буде недостатньо для досягнення цільового рівня ХС ЛПНЩ <55 мг/дл. Крім того, у певних категорій пацієнтів із ГКС особливо корисним може бути ранній початок лікування іPCSK9, з огляду на показану у двох невеликих дослідженнях безпеку такого підходу та пов'язану з ним високу частоту досягнення цільових значень ХС ЛПНЩ. Кандидатами на таку ГЛТ можуть бути пацієнти з додатковими ішемічними факторами ризику, такими як багатосудинне ураження коронарного русла або наявність СГХ з дуже високим рівнем ХС ЛПНЩ. Ще однією групою хворих, які можуть отримати користь від раннього призначення іPCSK9, можуть бути особи з повторною судинною катастрофою, що розвинулася менш ніж через 2 роки після першої СС події, незважаючи на приймання максимальної переносимої дози статину. Надзвичайно високий ризик і низька вірогідність досягнення цілей щодо ХС ЛПНЩ при використанні стандартної ГЛТ виправдовують призначення таким хворим іPCSK9 під час госпіталізації у зв'язку з ГКС, незважаючи на відсутність спеціальних досліджень з оцінки СС наслідків при застосуванні такої терапії. Окрім перелічених заходів, усі пацієнти з ГКС, особливо з підвищеним рівнем ХС ЛПНЩ або особистим/сімейним анамнезом передчасного ІМ, мають бути обстежені на наявність СГХ під час індексної госпіталізації з підтвердженням діагнозу СГХ результатами генетичного тестування. У пацієнтів із високою ймовірністю СГХ і рівнем ХС ЛПНЩ >190 мг/дл доцільним є проведення потрійної ГЛТ комбінацією ВІ статину, езетимібу та іPCSK9. Непереносимість статинів. Ідеальний алгоритм лікування при підозрі на непереносимість статинів ще не визначений, зокрема для ситуацій високого ризику, наприклад у ранньому періоді після ГКС. За результатами низки досліджень було висловлено припущення, що м’язові симптоми, які спостерігаються на тлі приймання статинів, можуть бути пов'язані з ефектом ноцебо, і показано, що великий відсоток таких пацієнтів успішно відновлює терапію статинами. На практиці для ефективного зниження рівнів атерогенних ліпідів у гострому періоді після ГКС за непереносимості статинів видається розумним призначити пацієнтові іPCSK9 у комбінації з езетимібом і паралельно спробувати відновити приймання статинів. У країнах, де іPCSK9 недоступні або витрати на них не відшкодовують або відшкодовують тільки в разі безуспішної стандартної терапії, пропонується розпочати лікування комбінацією езетимібу й бемпедоєвої кислоти та спробувати відновити приймання статинів із повторною оцінкою переносимості через 4–6 тижнів. Бемпедоєва кислота – це новий ГЛП, який інгібує фермент АТФ-цитрат-ліазу, що в процесі внутрішньопечінкового біосинтезу ХС передує реакціям за участю ГМГ-КоА-редуктази. Нині проводять дослідження CLEAR OUTCOMES (NCT02993406) з оцінки впливу одноразового щоденного приймання бемпедоєвої кислоти на ризик основних СС наслідків у 14 тис. пацієнтів із високим СС ризиком і непереносимістю статинів. Загалом, окрім використання в комбінації з езетимібом та іPCSK9 у разі непереносимості статинів, бемпедоєву кислоту можна застосовувати в пацієнтів, які не досягли цільових показників ХС ЛПНЩ на тлі подвійної ГЛТ комбінацією ВІ статину та езетимібу, якщо іPCSK9 недоступні або система охорони здоров'я не компенсує витрати на придбання іPCSK9. Ведення пацієнтів із ГКС після виписки зі стаціонару. Безперервність допомоги пацієнтам із ГКС часто порушується на ранньому етапі після виписки з лікарні, що негативно позначається на самопочутті й подальшому лікуванні пацієнтів. Тому для кожного хворого перед випискою має бути розроблений детальний план корекції ліпідного обміну з чітким алгоритмом візитів до лікаря для організації спостереження та подальшого лікування. Через 4–6 тижнів після виписки зі стаціонару необхідно повторно обстежити пацієнта, за можливості в тій самій лікарні, де його лікували первинно, або в іншій клініці, що спеціалізується на вторинній СС профілактиці в осіб із групи високого ризику, зокрема після ГКС. Під час обстеження необхідно оцінити досягнутий рівень ХС ЛПНЩ, переносимість терапії, прихильність до лікування, використання й ефективність інших заходів вторинної профілактики, оцінити необхідність ескалації терапії та відкоригувати реабілітаційні заходи. Наступне обов'язкове оцінювання проводять через 6–12 місяців після ГКС. Модифікація способу життя. Модифікація способу життя робить значний внесок у вторинну профілактику СС подій і потребує підвищеної уваги як під час первинного стаціонарного лікування, так і впродовж подальшого (амбулаторного й стаціонарного) спостереження та реабілітації. Основні зміни, що сприяють зниженню рівня ХС ЛПНЩ, включають зміну раціону, наприклад відмову від транс-жирів, зниження вмісту насичених жирів і ХС, збільшення споживання харчових волокон та нутрицевтиків. Також зниженню ХС ЛПНЩ сприяють корекція надлишкової маси тіла й збільшення регулярної фізичної активності. З повним текстом документа англійською мовою можна ознайомитися на офіційному сайті ESC за адресою https:// www.escardio.org/.
Список літератури знаходиться в редакції
Автор огляду Наталія Генш Medicine Review 2023; 4 (71): 22 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |