Артеріальна гіпертензія в пацієнтів з ожирінням: патофізіологічно обґрунтовані рекомендації з питань організації терапіїПаралельне зростання поширеності артеріальної гіпертензії (АГ) та ожиріння в загальній популяції очікувано призводить до постійного збільшення кількості хворих із комбінацією цих станів, водночас, незалежно від власної першопричини (спадкова схильність, спосіб життя та/або епігенетичні впливи), пов'язана з ожирінням АГ (в англомовній медичній літературі – obesity-related hypertension, OHT) є визнаною основною причиною серцево-судинної (СС) захворюваності й смертності [1]. Крім того, ОНТ часто супроводжується цукровим діабетом (ЦД) 2 типу, дисліпідемією та метаболічним синдромом, підвищеною схильністю до гіпертрофії лівого шлуночка й ниркової дисфункції [2], а також є переважаючим фактором ризику розвитку обструктивного апное сну, що зі свого боку посилює й без того підвищений симпатичний тонус та, як наслідок, призводить до розвитку й підтримання АГ [3]. Важливо також зазначити, що ожиріння є одним із предикторів резистентної гіпертензії, тобто неможливості знизити рівень артеріального тиску (АТ) до цільових значень, незважаючи на застосування трьох і більше антигіпертензивних препаратів (АГП), зокрема й діуретика [4,5], і це часто може бути пов'язане з недостатнім використанням симпатолітичних засобів центральної дії, яке залишає неконтрольованим важливий фактор, що сприяє підвищенню АТ. На відміну від худих людей, у яких АГ часто зумовлена підвищенням системного судинного опору, у хворих з ОНТ генез АГ є більш багатофакторним і здебільшого ґрунтується на порушеннях регуляції симпатичної нервової системи (СНС) та об'єму циркулюючої крові [6, 7]. Розуміння патофізіологічних особливостей ОНТ має велике значення в досягненні ефективного контролю АТ і поліпшенні СС наслідків у цій популяції пацієнтів.
Гіперактивність СНС в умовах ОНТ Пацієнти з ОНТ явно демонструють гіперсимпатикотонію, що характеризується виразними патернами збудження центральних симпатичних нейронів [8]. Посилення активності СНС спрямоване на збільшення енерговитрат і вважається компенсаторним механізмом відновлення енергетичного балансу на тлі надлишку поживних речовин [9]. Ця відповідь опосередковується через численні сигнальні шляхи, включно зі шляхами інсуліну, лептину, адипокінів, а також ренін-ангіотензин-альдостероновою системою (РААС). Крім того, з ожирінням асоціюється низка структурних/анатомічних змін, що сприяють появі апное сну й стисненню нирок із подальшими гіперфільтрацією, підвищенням внутрішньониркового тиску та порушенням натрійурезу [7]. Усі ці процеси/зміни створюють самопідтримувальний каскад, який посилює симпатичну стимуляцію органів регуляції АТ, таких як серце, периферичні судини й нирки [8, 10]. Фармакологічні дослідження, що проводилися з використанням різних методик, чітко демонструють надлишкову активність симпатичних нервів, яка робить істотний внесок у розвиток АГ при ожирінні [11, 12]. Комбінована адренергічна (α + β) блокада доксазозином й атенололом показала більш виражене зниження АТ в пацієнтів з ОНТ порівняно з худими пацієнтами [13]. Аналогічний підхід із використанням гангліоблокатора триметафану, що викликає повну, але скороминущу вегетативну блокаду, показав, що в осіб з ожирінням підвищення АТ здебільшого опосередковано активністю СНС [14]. У більшості випадків ОНТ розвивається як нейрогенна АГ, часто супроводжується перевантаженням об'ємом, неадекватною стимуляцією РААС і гормональною резистентністю (до інсуліну й лептину) та ускладнюється синдромом обструктивного апное сну, що стає основою для розвитку резистентної АГ.
Антигіпертензивна фармакотерапія хворих з ОНТ Зниження маси тіла. Оскільки гіперсимпатикотонія відіграє центральну роль у патогенезі гіпертензії при ОНТ, терапевтичний вплив на СНС є пріоритетним завданням, якому, однак, не приділяється належної уваги. Першим кроком у лікуванні ОНТ має бути корекція ожиріння, оскільки зниження ваги саме по собі доведено зменшує центральну симпатичну імпульсацію й асоціюється зі зниженням СС смертності та захворюваності [15, 16]. Проте, незважаючи на безсумнівну користь, зниження ваги не корелює лінійно зі зниженням АТ [17], а заходи щодо модифікації способу життя (наприклад, дієта, підвищення фізичної активності, зменшення вживання алкоголю й солі), хоча і сприяють зниженню АТ на етапі боротьби з ожирінням, не завжди зберігають свій сприятливий ефект у довгостроковій перспективі [18]. У результаті, після завершення терапії ожиріння й виходу маси тіла на плато в більшості людей, як правило, залишаються надмірна вага й нестійкий АТ [19]. З огляду на ці проблеми, досить імовірно, що переважній більшості пацієнтів з OHT буде потрібна фармакотерапія із застосуванням АГП. Сучасні настанови, хоча й коментують деякі загальні принципи фармакотерапії, не дають конкретних рекомендацій щодо кращого вибору АГП при ОНТ, і лікарям доводиться підбирати терапію, ґрунтуючись на знанні особливостей патофізіології гіпертензії при ОНТ [20].

АГП першої лінії. Як правило, хворим з ОНТ показана комбінована антигіпертензивна терапія (АГТ), зазвичай – комбінацією інгібітора РААС (інгібітора ангіотензинперетворюючого ферменту [ІАПФ] або блокатора рецепторів ангіотензину [БРА]) з блокатором кальцієвих каналів (БКК) і/ або діуретиком. Блокада РААС не тільки покращує контроль АТ, а й сприятливо впливає на запалення, окислювальний стрес і вуглеводний обмін, а також покращує наслідки СС захворювань і хронічної хвороби нирок, сповільнює прогресування діабетичної нефропатії та чинить позитивний вплив на ліпідний обмін [21–24]. З огляду на широкий спектр корисних ефектів, що забезпечують метаболічний і СС захист, а також на відмінну переносимість, інгібітори РААС вважаються АГП першої лінії при OHT [25–27]. Слід зазначити, що ІАПФ доведено покращують чутливість тканин до глюкози [28, 29], знижують рівень лептину в плазмі й пригнічують активність СНС при ожирінні [29]. За вираженістю симпатолітичного ефекту ІАПФ поступаються центральним агоністам імідазолінових рецепторів (наприклад, моксонідину), однак у поєднанні з іншими ефектами пригнічення СНС надає ІАПФ перевагу над БРА в терапії ОНТ. Втім, порівняння метаболічних ефектів різних БРА показало, що телмісартан, стимулюючи гамма-рецептор, який активують проліфератори пероксисом (PPARγ, добре відома терапевтична мішень при ЦД 2 типу й метаболічному синдромі [30]), знижує масу тіла та підвищує рівень адипонектину в сироватці крові в пацієнтів з АГ і непереносимістю глюкози краще, ніж кандесартан, що не діє на PPARγ, і це робить телмісартан кращим БРА для лікування захворювань, пов'язаних з ожирінням. Результати клінічних досліджень ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial) і TRANSEND (Telmisartan Randomized Assessment Study in ACE inhibitor Intolerant Patients with Cardiovascular Disease), а також низка нещодавніх метааналізів рандомізованих досліджень, у яких оцінювали ефективність та безпечність ІАПФ і БРА, показали, що монотерапія цими препаратами або їх використання в складі комбінацій із додаванням діуретиків або без них ефективні для початкового лікування ОНТ у пацієнтів із різними рівнями СС ризику [31]. Інші стратегії блокування РААС, які використовують у лікуванні OHT, включають пряме інгібування реніну й блокаду мінералокортикоїдних рецепторів. Прямі інгібітори реніну (ПІР), такі як аліскірен, знижують АТ у ступені, зіставному з іншими блокаторами РААС [32–34], але не продемонстрували переваг у зниженні первинних СС або ниркових наслідків [35] і, за повідомленнями, їх застосування асоціюється з вищою частотою небажаних явищ, таких як інсульт і гіперкаліємія [36–38]. Призначення антагоністів мінералокортикоїдних рецепторів (АМР) може бути ефективною стратегією АГТ, особливо в пацієнтів із гіпертензією, рефрактерною до АГП, яка часто поєднується з ожирінням, що може пояснюватися генералізованим підвищенням активності РААС при ожирінні [39–41]. Проте при виборі кращого АГП слід враховувати побічні ефекти АМР, зокрема, гіперкаліємію, а також (для неспецифічного АМР спіронолактону) гінекомастію/нагрубання молочних залоз і зниження лібідо в чоловіків. Як було сказано вище, більшості хворих з ОНТ показано комбіновану АГТ, і як другий компонент (на додаток до інгібітора РААС) рекомендується використовувати метаболічно нейтральні дигідропіридинові (ДГП) БКК, надаючи перевагу більш новим препаратам (наприклад, амлодипіну й фелодипіну) [42]. Симпатолітики центральної дії як АГП другої лінії. З огляду на важливу роль гіперсимпатикотонії в патогенезі ОНТ, викликає здивування недостатнє використання можливостей блокади СНС за допомогою агоністів імідазолінових I1-рецепторів. Частково це можна пояснити хибними уявленнями, пов’язаними з перенесенням відомостей про несприятливі ефекти старих центральних симпатолітиків (клонідину або α-метилдопи), зокрема втому, седацію й повернення гіпертензії після скасування препарату, на новіших представників класу (моксонідин і рилменідин), які довели свою переносимість та ефективність у зниженні АТ [20]. На відміну від клонідину, який взаємодіє з центральними α2-рецепторами, новіші представники фармакологічного класу зв’язуються з імідазоліновими I1-рецепторами, що дає змогу значною мірою уникати побічних ефектів, притаманних клонідину. За ступенем впливу на рівень АТ моксонідин можна порівняти з амлодипіном, однак, окрім антигіпертензивної дії, моксонідин покращує чутливість тканин до інсуліну, знижує рівень лептину в плазмі, усуває гіперсимпатикотонію, сприяє зниженню маси тіла, покращенню метаболізму глюкози й корекції дисліпідемії в пацієнтів з ОНТ [43–47]. Крім того, застосування моксонідину було пов’язане зі сприятливими СС і нирковими ефектами, зокрема зниженням швидкості прогресування ниркової недостатності [48, 49], гіпертрофії лівого шлуночка й ендотеліальної дисфункції [50] – супутніх порушень, типових для людей з ожирінням. Отже, при ОНТ корекція гіперактивності СНС за допомогою агоністів імідазолінових I1-рецепторів нового покоління може розглядатися як краща антигіпертензивна стратегія другої лінії [20]. Інші АГП у лікуванні ОНТ. Гіперволемія й затримка нат рію при ОНТ обґрунтовують застосування сечогінних препаратів, включно з тіазидними, петльовими й калійзберігаючими діуретиками [51]. Діуретики, як правило, добре переносяться й за антигіпертензивною ефективністю не поступаються іншим класам АГП [52], проте їх застосування може бути пов'язане з несприятливими метаболічними ефектами. Наприклад, тіазидні діуретики посилюють інсулінорезистентність і дисліпідемію й асоціюються з розвитком нових випадків ЦД 2 типу. Крім того, діуретики зазвичай стимулюють активність СНС і РААС, що потенційно послаблює деякі їхні корисні ефекти. Застосування діуретиків також може призвести до розвитку гіпонатріємії, гіперкальціємії, гіперурикемії та гіпокаліємії [53, 54], особливо в літніх людей. Проте у більшості пацієнтів з ОНТ наявний певний ступінь перевантаження об'ємом, тому застосування низьких доз діуретиків у комбінації з іншими АГП, що протидіють індукованій діуретиками стимуляції РААС і СНС (тобто – з блокаторами РААС і симпатолітичними засобами центральної дії), часто дуже допомагає мінімізувати несприятливі метаболічні ефекти й досягти кращого контролю АТ [55]. За відсутності вираженої застійної серцевої недостатності й ниркової недостатності тіазидні та тіазидоподібні діуретики мають перевагу над петльовими діуретиками. Порівняно з гідрохлоротіазидом хлорталідон має триваліший період напіввиведення, він дещо ефективніший у зниженні АТ [56], з більшою вірогідністю пов'язаний із несприятливими метаболічними ефектами, але при цьому значно знижує ризик СС наслідків [57, 58]. Ґрунтуючись на цих спостереженнях, запропоновано вважати хлорталідон, який призначають у низьких і середніх дозах, діуретиком вибору при ОНТ [56, 59]. Тіазидні діуретики, такі як індапамід, значно знижують АТ при нейтральному впливі на ліпідний профіль і метаболізм глюкози у хворих із ЦД 2 типу, а також не спричиняють розвиток гіпокаліємії або гіперурикемії [60]. Серед петльових діуретиків торасемід має тривалий період напіввиведення при щоденному прийманні один раз на добу й може бути кращим варіантом у разі, якщо для контролю АТ потрібен петльовий діуретик [61]. Слід зазначити, що застосування в комбінації з ІАПФ, БРА, АМР або калійзберігаючим діуретиком (амілорид або триамтерен) знижує ризик гіпокаліємії, спричиненої тіазидними діуретиками [20].
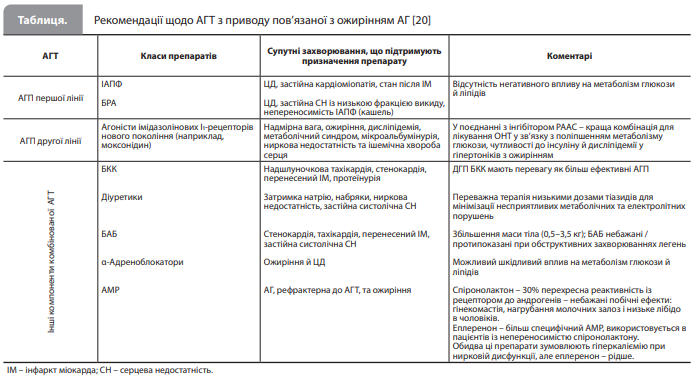
Бета-адреноблокатори (БАБ), крім зниження рівня АТ, забезпечують цілу низку додаткових корисних ефектів, зокрема знижують рівень захворюваності й смертності в осіб з ожирінням і ЦД 2 типу [62–64]. Однак із застосуванням БАБ пов’язані небажані метаболічні зміни, включаючи збільшення маси тіла, розвиток інсулінорезистентності й підвищений ризик розвитку нових випадків ЦД 2 типу [65–67]. Крім того, ступінь зниження центрального тиску в аорті під впливом БАБ може бути меншим, ніж у периферичних артеріях, що знижує ефективність БАБ у профілактиці інсульту, зокрема, у курців, порівняно з іншими АГП [68, 69]. Тому БАБ не вважаються кращою терапією ОНТ. Винятком можуть бути вазодилатуючі БАБ (карведилол і небіволол), які позбавлені негативних метаболічних ефектів, зокрема збільшення маси тіла, і тому їх рекомендують за наявності показань до β-адреноблокади в контексті ожиріння й АГ [70, 71]. Периферичні вазодилататори, включно з α-адреноблокаторами, гідралазином тощо, можуть бути дуже корисними, якщо необхідного зниження АТ не вдається досягти за допомогою вищезгаданих класів АГП або за непереносимості АГП перших ліній. Вплив периферичних вазодилататорів на метаболічний профіль вважається нейтральним; однак їх застосування, особливо в літніх людей, можуть обмежувати ризики ортостатичної гіпотензії та інших неметаболічних побічних ефектів [20].
Фармакотерапія ожиріння у хворих з ОНТ Якщо модифікації способу життя недостатньо для досягнення бажаної маси тіла, очевидним наступним кроком є призначення фармакотерапії. Проте при ОНТ можливість застосування препаратів проти ожиріння потребує ретельного вивчення через низку потенційних побічних ефектів. Зокрема, деякі препарати (наприклад, фентермін) знижують масу тіла за рахунок активації СНС з метою збільшення енерговитрат у стані спокою й подальшого зниження споживання їжі [72, 73]. Як наслідок, застосування фентерміну зазвичай супроводжується збільшенням частоти серцевих скорочень та АТ і тому обмежене молодими пацієнтами без ознак активного або нестабільного коронарного захворювання чи неконтрольованої АГ. Останнім часом дедалі більшу увагу привертає можливість лікування ожиріння за допомогою нових класів препаратів – агоністів рецепторів глюкагоноподібного пептиду (ГПП)-1 [74] та інгібіторів натрійзалежного котранспортера глюкози 2 типу (НЗКТГ2). Агоністи ГПП-1 не чинять значного впливу на АТ, але знижують СС ризик і можуть безпечно застосовуватися в пацієнтів із ЦД 2 типу, переддіабетом або порушеною толерантністю до глюкози, а також у пацієнтів, які потребують застосування психіатричних препаратів [75-77]. Інгібітори НЗКТГ2 приводять до зниження АТ у пацієнтів із ЦД 2 типу, що може сприяти поліпшенню СС прогнозу [78].
Висновки Загалом, терапія пацієнтів із комбінацією ожиріння й АГ має бути індивідуалізована з урахуванням причини та ступеня тяжкості АГ, наявності ознак ураження органів-мішеней, відповіді на лікування, присутності інших чинників ризику й супутніх захворювань, які визначають прогноз і вимоги до тактики ведення пацієнта. Хоча початковою стратегією лікування має бути модифікація способу життя за допомогою дієти й фізичних навантажень, більшості пацієнтів не вдається нормалізувати або знизити масу тіла та підтримувати досягнутий результат з метою нормалізації АТ. У таблиці надано стислий огляд рекомендацій щодо патофізіологічно обґрунтованого вибору схеми АГТ для лікування ОНТ, що забезпечує не тільки контроль АТ, а й поліпшення СС наслідків. Проте треба враховувати, що ці поради базуються на знаннях про патофізіологію ОНТ і результатах обмеженої кількості механістичних досліджень, що підкреслює необхідність проведення добре спланованих рандомізованих контрольованих клінічних досліджень для підтвердження вищевказаних рекомендацій.
Список літератури знаходиться в редакції
Автор огляду Віктор Мицьо Medicine Review 2023; 2 (69): 49 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2024. Усі права захищені.
|
мапа сайту корисні посилання |