Прискорена титрація та персоналізований підбір хворобомодифікуючої терапії серцевої недостатності зі зниженою фракцією викиду: дані дослідження з моделюванням ефектів різних послідовностей препаратівТривалий час стандартна терапія серцевої недостатності (СН) зі зниженою фракцією викиду (СНзнФВ) була заснована на використанні блокаторів ренін-ангіотензинової системи (РАС), β-адреноблокаторів (БАБ) і антагоністів мінералокортикоїдних рецепторів (АМР) [1–5], але нещодавно до цієї групи були включені ще два фармакологічні класи препаратів – інгібітор неприлізину та інгібітори натрійзалежного котранспортеру глюкози 2 типу (іНЗКТГ2), – які, за даними клінічних досліджень, покращують виживаність при додаванні до вище перелічених традиційних лікарських засобів проти СН. Донедавна практичні настанови та пов’язані з ними поради щодо призначення препаратів рекомендували проводити лікування СНзнФВ за схемою, яка відповідає хронології проведення клінічних досліджень, тобто починати з призначення інгібітора ангіотензинперетворюючого ферменту (іАПФ) або блокатора рецептора ангіотензину (БРА), потім призначати БАБ з наступним додаванням АМР, переходом до сакубітрилу/ валсартану (тобто додаванням інгібітора неприлізину) та, останнім етапом, додаванням іНЗКТГ2 (хоча подібна етапність призначення препаратів не була відображена в настанові Європейського товариства кардіологів від 2021 р.) [1, 2, 6]. Також попередніми настановами було рекомендовано поступово підвищувати дозу кожного препарату до цільової або максимальної переносимої перед тим, як призначати наступний вказаний у схемі лікарський засіб [1, 2]. Але швидко постало питання щодо коректності цього підходу до терапії СНзнФВ, оскільки було визнано, що кожен з цих п’яти зберігаючих життя класів препаратів діє незалежно, що їх ефекти є адитивними, а також що кожен з них проявляє користь в короткий термін (протягом 30 днів) після початку приймання. Тому відбулася зміна парадигми, і головною метою став якнайшвидший початок терапії якомога більшою кількістю препаратів для лікування СН. При дотриманні цього підходу важливо враховувати кількість кроків титрування дози та час, необхідний для досягнення науково-обґрунтованої дози, оскільки ці показники суттєво різняться, наприклад у БАБ та іНЗКТГ2, з яких першій групі потрібно до чотирьох етапів титрування протягом 6–12 тижнів, а друга використовується в одній фіксованій дозі для всіх пацієнтів [1–5]. З метою більш глибокого вивчення варіантів призначення препаратів для лікування СНзнФВ Shen et al. змоделювали вплив більш швидкого підбору терапії з використанням традиційного порядку препаратів і призначення зберігаючих життя при СН лікарських засобів у різних порядках, зокрема при одночасному призначенні двох препаратів з різних фармакологічних груп на початку лікування. Метою дослідження була кількісна оцінка потенційного зменшення кількості госпіталізацій та смертей у результаті слідування альтернативним підходам. Нижче стисло представлені отримані результаті [7].
Основні характеристики аналізу Shen et al. У вказаному аналізі автори використали п’ять досліджень, проведених за участю пацієнтів зі СНзнФВ, щоб оцінити ефект лікування п’ятьма хворобомодифікуючими препаратами. Дані про ефекти цих класів препаратів були отримані з наступних досліджень: інгібування РАС – з дослідження Studies of Left Ventricular Dysfunction (SOLVD)Treatment [8], БАБ – з дослідження Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF) [9], АМР – з дослідження Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure (EMPHASIS-HF) [10], інгібітор неприлізину/блокатор рецепторів ангіотензину (ARNI) – з дослідження ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF), іНЗКТГ2 – з дослідження Dapagliflozin and Prevention of Adverse Outcomes in Heart Failure (DAPAHF) [4]. Для створення вибірки пацієнтів зі СНзнФВ, які раніше не отримували жоден з п'яти фармакологічних класів препаратів, що знижують смертність, використовували комбіновану когорту учасників, рандомізованих у групу плацебо, з досліджень SOLVD-Treatment (еналаприл vs плацебо) і Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM)-Alternative (кандесартан vs плацебо) [11], які не отримували БАБ або АМР (табл. 1). Вказаний набір даних використовували для визначення показників частоти наслідків, які становили інтерес.
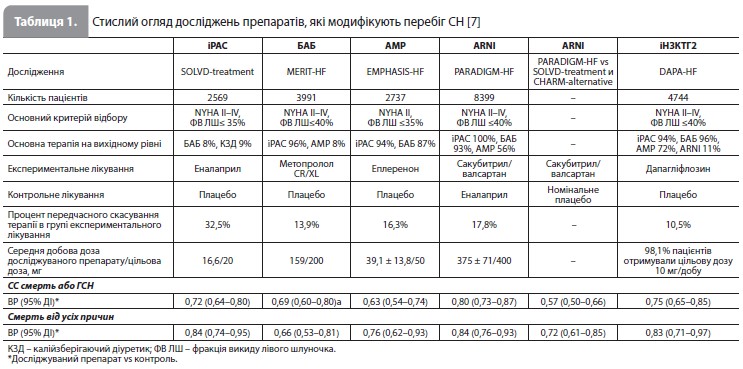
У наведених дослідженнях використовувалися такі первинні кінцеві точки: смерть від усіх причин – у SOLVDTreatment і MERIT-HF, комбінація серцево-судинної (СС) смерті і госпіталізації з приводу СН (ГСН) – у CHARMAlternative, EMPHASIS-HF і PARADIGM-HF, а також комбінація СС смерті і погіршення СН – в DAPA-HF (на думку авторів аналізу, ця кінцева точка мало відрізнялася від комбінації СС смерті і ГСН, яка була першою вторинною кінцевою точкою в DAPA-HF). Отже, у даному аналізі основними досліджуваними наслідками були сукупність СС смерті і ГСН, а також смерть від усіх причин. Для розрахування частоти досліджуваних наслідків у когорті пацієнтів зі СНзнФВ використовували оцінки за методом Каплана–Меєра. Оскільки ризик ГСН був відносно високим на початку досліджень і знижувався пізніше, ризики ГСН та комбінації ГСН і СС смерті оцінювали окремо протягом перших 6 місяців і після 6 місяців лікування. У якості показників лікувальних ефектів різних видів терапії використовували відношення ризиків (ВР) наслідків, опублікованих у наведених вище дослідженнях. Винятком стало дослідження MERIT-HF, у якому не розраховувалося ВР для комбінації ГСН і СС смерті і замість нього використовувалося ВР для комбінації ГСН и смерті від усіх причин. Звичайна послідовність (тобто послідовність 1), яка вивчалася в цьому дослідженні, виглядала так: початкове призначення інгібітора РАС (іРАС) з поступовим збільшенням дози протягом 6 тижнів, подальше титрування БАБ протягом 6 тижнів, потім АМР протягом 4 тижнів, перехід з іРАС на ARNI протягом 6 тижнів і, нарешті, додавання іНЗКТГ2 з остаточною оцінкою пацієнта через 2 тижні. Прискорений варіант цієї послідовності (послідовність 1a) вводив препарати в тому ж порядку, але прискорював швидкість титрування ось так: іРАС протягом 4 тижнів, БАБ протягом 4 тижнів, АМР протягом 2 тижнів, ARNI протягом 5 тижнів і наступне призначення іНЗКТГ2 з остаточною оцінкою пацієнта через 1 тиждень. Використовуючи ту саму шкалу прискореного титрування, що й у послідовності 1a, автори додатково вивчили 12 інших послідовностей, серед яких не було послідовностей с окремим призначенням іРАС, який у всіх випадках замінювали на ARNI (комбінація сакубітрил/валсартан). Порядок приймання препаратів за схемою ARNI – БАБ – АМР – іНЗКТГ2 описується як послідовність 1b, а 11 додаткових варіантів – як послідовності 2–12. Нарешті, враховуючи недавні пропозиції щодо можливості одночасного початку терапії двома препаратами з двох різних фармакологічних класів, автори також вивчили послідовності з початковим призначенням різних комбінацій двох препаратів (послідовності 1К– 6К) (рис. 1). Були розраховані показники вірогідності подій і середній показник втрати часу без подій (mean event-free time lost) за 1, 2 і 3 роки у пацієнтів, які не отримували жодного з досліджуваних методів лікування, а потім у пацієнтів, що отримували ліки згідно до вище означених послідовностей. Для обчислення середнього показника втрати часу без подій розраховували площу під кривою «час–імовірність події» за 1, 2 та 3 роки. Середній показник втрати часу без подій у певний момент часу показує усереднену втрату часу без подій для одного пацієнта. Наприклад, за 1 рік померли 100 з 1000 пацієнтів, і якщо припустити, що частота подій є постійною, середня втрата часу без подій (тобто часу виживання) за 1 рік для одного пацієнта становить у середньому ~0,6 місяця, а для всіх 1000 пацієнтів – близько 50 років. Також розраховували різницю у вірогідності події та середньому показнику приросту часу без подій при використанні послідовностей 2–12 порівняно зі звичайними послідовностями 1, 1a та 1b. Окремо вивчали ефекти послідовностей з використанням комбінацій (послідовності 1К–6К із початковим призначенням подвійних комбінацій) порівняно з послідовністю 1b. У первинному аналізі автори припустили, що ефект лікування починається в середині періоду титрування для кожного препарату. Також були проведені два аналізи чутливості, один з яких припускав, що повний ефект кожного препарату був присутнім з початку лікування, а другий, що повний ефект був очевидний лише після завершення періоду титрування.
Результати аналізу Shen et al. Використані клінічні дослідження та результати лікування, включені в моделі, підсумовані в таблиці 1. У популяції пацієнтів зі СНзнФВ, які раніше не отримували лікування (учасники з груп плацебо досліджень SOLVD-Treatment і CHARM-Alternative), частота подій з комбінації ГСН і СС смерть становила 460 на 1000 пацієнтороків протягом перших 6 місяців і 200 на 1000 пацієнтороків після 6 місяців. Частота ГСН становила 310 і 130 на 1000 пацієнто-років відповідно. Показники частоти смерті від усіх причин і СС смерті протягом усього досліджуваного періоду становили 150 і 130 на 1000 пацієнтороків відповідно.
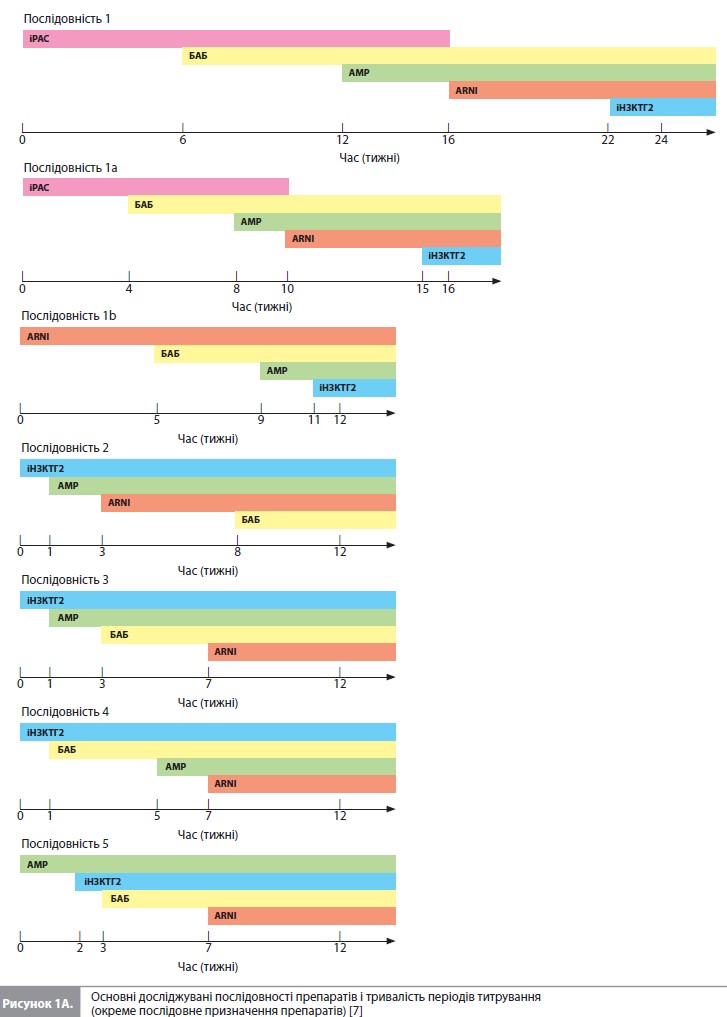
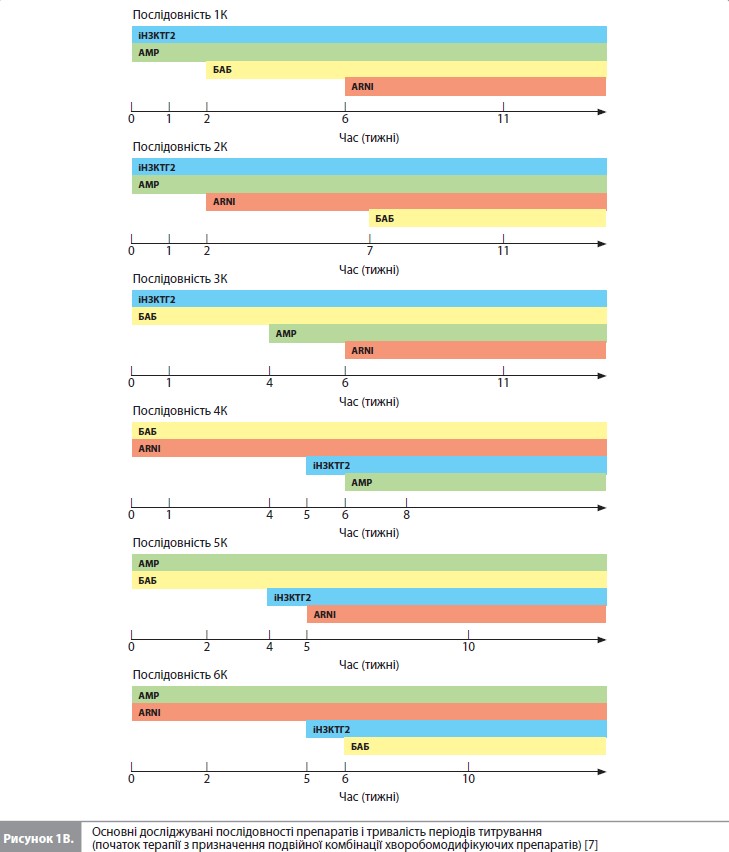
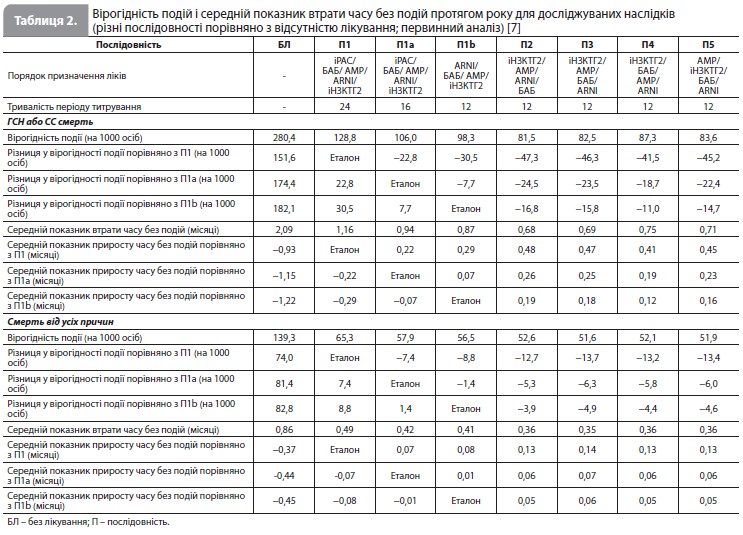
Перше порівняння досліджувало наслідки прискореного титрування доз при використанні традиційної послідовності призначення препаратів (послідовність 1a vs послідовність 1). Рисунок 2 показує, що цей прискорений підхід скоротив час до закінчення титрування з 24 до 16 тижнів. Як видно з таблиці 2, використання цієї схеми прискореного титрування у 1000 пацієнтів зменшило кількість пацієнтів з ГСН або СС смертю на 23 особи, а також супроводжувалося меншою (на 7 випадків) кількістю смертей за перші 12 місяців після початку лікування (рис. 2). Наступні порівняння досліджували наслідки використання різних препаратів у різному порядку, зберігаючи більш швидке титрування дози кожного з них.

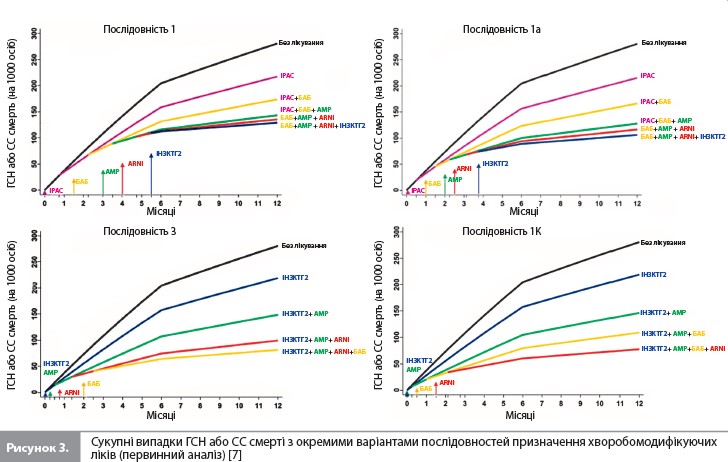
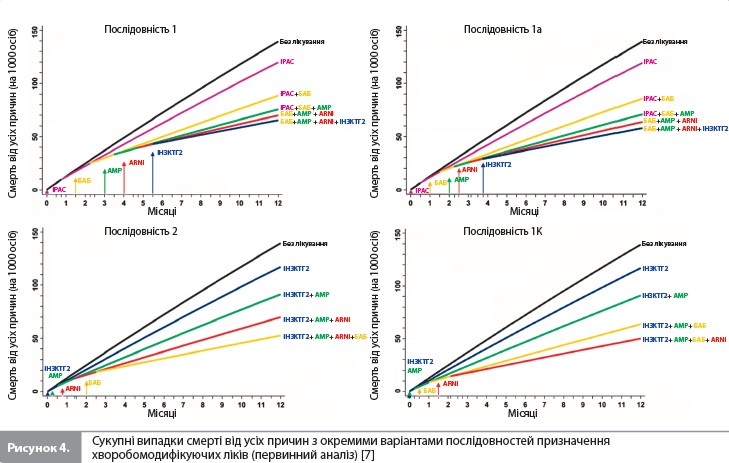
Перший розглянутий варіант (послідовність 1b) починався з призначення ARNI, а не з іРАС, і передбачав швидке титрування усіх ліків, як у послідовності 1a. Оскільки це дозволило уникнути початку лікування з іРАС і більш пізнього переходу на ARNI, загальний час, необхідний для титрування, було скорочено з 16 до 12 тижнів. Порівняно з послідовністю 1a, використання послідовності 1b зменшило кількість пацієнтів з ГСН або СС смертю на 8 осіб, а також супроводжувалося меншою (на 1 випадок) кількістю смертей за перші 12 місяців після початку лікування. Наступні розглянуті варіанти також використовували ARNI (а не іРАС), який призначався на різних етапах підбору терапії, і для кожній із цих послідовностей загальний час, необхідний для титрування, завжди становив 12 тижнів. Найефективніші альтернативні підходи (послідовності 2–5 vs послідовність 1b) призвели до подальшого зниження летальних та нелетальних подій протягом 12 місяців. Послідовності 3, 4 і 5 посприяли якнайшвидшому досягненню етапу лікування всіма чотирма препаратами (7 тижнів), а послідовності 2, 3 і 5 дали змогу розпочати застосування трьох препаратів через 3 тижні. Послідовністю, яка забезпечувала найбільше зменшення ризику подій з комбінації ГСН і СС смерть, була послідовність 2 (іНЗКТГ2/АМР/ARNI/БАБ). Порівняно з послідовністю 1b послідовність 2, за оцінками, знизила кількість пацієнтів з такими ускладненнями на 17 осіб (рис. 2). Послідовність 3 привела до подібного, хоча трохи менш вираженого ефекту. Проте коли послідовність 2 порівнювали зі звичайним підходом (послідовністю 1), кількість пацієнтів, які уникнули ГСН/СС смерті становила 47 на 1000 пролікованих хворих, що стало наслідком як збільшення швидкості титрування, так і зміни порядку призначення препаратів. Найкращою альтернативною послідовністю для зниження смертності від усіх причин була послідовність 3 (іНЗКТГ2/ АМР/БАБ/ARNI). Порівняно з послідовністю 1b послідовність 3 запобігала ~5 смертям на 1000 пацієнтів, які отримували лікування протягом 12 місяців (рис. 2). Послідовності 4 і 5 призвели до дещо меншого зниження ризику смерті від усіх причин порівняно з послідовністю 3. Якщо послідовність 3 порівнювати зі звичайним підходом (послідовність 1), кількість пацієнтів, які уникнули передчасної смерті, становила 14 на 1000 пролікованих хворих, що відображає вплив як більш швидкого титрування, так і різного порядку призначення досліджуваних препаратів. Послідовностями, які продемонстрували найменшу користь для зниження смертності, були послідовності, які починаються з призначення сакубітрилу/валсартану. Нарешті, вивчався вплив початку терапії з одночасного прийому двох препаратів за умови збереження більш швидкого титрування дози кожного лікарського засобу (рис. 2, табл. 3) [7]. Порівняно з послідовністю 1b найбільше зниження ризику комбінації ГСН і СС смерті забезпечувала послідовність, яка починалася з призначення комбінації іНЗКТГ2 + АМР, з наступним підключенням ARNI, а потім – БАБ; майже такою ж ефективною була послідовність іНЗКТГ2 + АМР/ БАБ/ARNI. Ці послідовності запобігали розвитку 21–22 подій ГСН/СС смерті на 1000 пацієнтів, які отримували лікування протягом 12 місяців, порівняно з послідовністю 1b (табл. 3) і додатково знижували ризик на 4–5 подій порівняно з найкращою прискореною послідовністю, тобто з послідовністю 2 (табл. 2) [7]. Для запобігання смерті від усіх причин найбільш ефективною була послідовність АМР + БАБ/ іНЗКТГ2/ ARNI, за якою слідувала послідовність іНЗКТГ2 + АМР/БАБ/ ARNI (аналогічно впливу на комбінацію ГСН и СС смерті). За оцінками, ці послідовності запобігають 7 смертям на 1000 пацієнтів, які отримували лікування протягом 12 місяців, порівняно з послідовністю 1b (табл. 3) і додатково знижують кількість смертей на 2 випадки порівняно з найкращою прискореною послідовністю, тобто послідовністю 3 (табл. 2) [7]. Слід зазначити, що послідовність БАБ + ARNI/іНЗКТГ2/АМР істотно скоротила теоретичний загальний час до повного титрування всіх препаратів (до 8 тижнів), але не була особливо ефективною у додатковому зниженні ризику того чи іншого наслідку. Сумарне зниження ризику з окремими послідовностями препаратів показано графічно для комбінації ГСН і СС смерті на рисунку 3 і для смертності від усіх причин на рисунку 4.
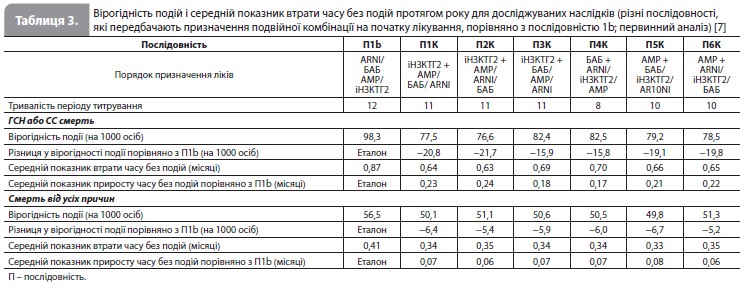
Обговорення результатів Отже, результати аналізу Shen et al. показують, що звичайний підхід до впровадження основних фармакологічних методів лікування СНзнФВ може бути не найкращим і що альтернативні підходи можуть призвести до значного зменшення смертей і госпіталізацій з приводу СН. Зокрема, проведене моделювання припускає, що завдяки використанню більш оптимальної послідовності призначення препаратів і більш швидкого титрування доз протягом першого року після встановлення діагнозу кількість осіб, що вижили, може збільшитися на 14 пацієнтів, а кількість пацієнтів, що уникнули першої ГСН або смерті від СС причин, може збільшитися втричі при розрахунку на 1000 пролікованих осіб (рис. 2). Ці результаті узгоджуються з парадигмою, згідно з якою, якщо препарати діють самостійно, адитивно і швидко (про що свідчать докази), то важливо щонайшвидше призначити якомога більшу кількість ефективних методів лікування, щоб якомога швидше максимально захистити пацієнта, оскільки в умовах СНзнФВ затримка в максимізації фармакологічного захисту означає втрату життів [7].

Упродовж свого дослідження Shen et al. змоделювали дві альтернативи звичайному підходу до лікування: одна полягала в тому, щоб підтримувати звичайну послідовність препаратів та скоротити час, необхідний для титрування кожного з них до цільової дози; інша – у тому, щоб розглянути кілька різних послідовностей уведення нових препаратів у схему лікування з використанням графіку прискореного титрування. Одне тільки скорочення часу, необхідного для титрування, забезпечило приблизно половину загального зменшення кількості смертей і госпіталізацій, якого, за розрахунками, було можливо досягнути за допомогою оптимального підходу до лікування. На думку авторів аналізу, змодельовані скорочені періоди титрування (іРАС протягом 4 тижнів, БАБ протягом 4 тижнів, АМР протягом 2 тижнів, ARNI протягом 5 тижнів і іНЗКТГ2 протягом 1 тижня) є придатними для багатьох пацієнтів і вже продемонстрували свою практичність і безпечність у різноманітних дослідженнях [12–14]. Альтернативні послідовності передбачали як більш швидке титрування дози, так і інший порядок введення нових препаратів. При вивченні нових послідовностей автори аналізу не розглядали можливість початку терапії з призначення іРАС, оскільки такий підхід характеризується найменшою загальною перевагою з погляду впливу на смертність (ВР 0,84, 95% ДІ 0,74–0,95) та пов'язаний із найбільшою затримкою початку приймання всіх п'яти хворобомодифікуючих препаратів [15–17]. Натомість розглядалися лише варіанти застосування іРАС у складі комбінації з інгібітором неприлізину (сакубітрил/валсартан), яка добре переноситься як початкове лікування [12–14]. Однак послідовність, у якій першим етапом було призначення комбінації сакубітрил/ валсартан, виявилася менш ефективною, ніж інші нові послідовності. Частково це було пов'язано з тим, що для досягнення цільової дози сакубітрилу/валсартану потрібні два або три етапи титрування (залежно від початкової дози) з перевіркою рівнів електролітів та функції нирок на кожному етапі, і навіть при прискореному режимі титрування для досягнення оптимальної дози, за оцінками, потрібно було 5 тижнів [12–14]. Найбільш ефективними були альтернативні послідовності, які починалися з призначення іНЗКТГ2 або АМР; перевагою іНЗКТГ2 у цьому випадку було використання фіксованої дози (титрування АМР проводиться максимум у 2 етапи), а перевагою АМР – більш виражений вплив на ризик смерті від усіх причин (ВР для АМР 0,76, 95% ДІ 0,62–0,93; ВР для іНЗКТГ2 0,83, 95% ДІ 0,71–0,97), проте відмінності між цими двома послідовностями за загальним впливом на досліджувані наслідки були незначними. Хоча БАБ є найефективнішими препаратами для зниження смертності (ВР 0,66, 95% ДІ 0,53–0,81), вони ж характеризуються найповільнішим процесом титрування, оскільки терапія БАБ зазвичай починається з дози, що становить 1/16–1/8 від цільової, і подвоєння дози проводиться з інтервалом не менше ніж 2 тижні. До того ж, моделювання показало, що навіть при скороченні періоду титрування до 4 тижнів початок лікування з призначення БАБ не призвів до кращих результатів, ніж застосування альтернативних послідовностей. Аналогічним чином, схема з одночасним призначенням двох препаратів на початковому етапі терапії, яка пропонується деякими вченими, мала скромний додатковий ефект [12–14]. При інтерпретації отриманих результатів слід враховувати низку відмінностей умов клінічних досліджень від реальної медичної практики, зокрема нижчий рівень прихильності до лікування серед реальних пацієнтів, що, ймовірно, призведе до зниження користі від застосування досліджуваних схем лікування в реальних умовах. Різним пацієнтам можуть краще підходити різні досліджувані послідовності, тому необхідно враховувати додаткові фактори, пов'язані з переносимістю лікування, такі як рівень артеріального тиску та функція нирок, а також дані про синергізм між препаратами (наприклад, уповільнення темпів зниження швидкості клубочкової фільтрації та корекція гіперкаліємії при сумісному інгібуванні неприлізину та НЗКТГ2) [18–20]. Також важливою змінною може бути вік, тому прискорене запровадження кількох видів лікування може виявитися недоцільним у літніх коморбідних пацієнтів.
Висновок Порівняно зі звичайними схемами титрування доз та рекомендованою послідовністю призначення хворобомодифікуючих препаратів при СНзнФВ, прискорений графік титрування та оптимізований порядок призначення можуть запобігти щонайменше 14 смертям і більш ніж утричі знизити кількість пацієнтів з госпіталізацією з приводу СН або смертю від СС причин протягом року після початку терапії при розрахунку на 1000 пролікованих пацієнтів. З огляду на ці результати, ефекти альтернативних підходів слід перевірити у належних клінічних дослідженнях.
Список літератури знаходиться в редакції
Автор огляду Наталія Генш Medicine Review 2022; 2 (65): 12 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2025. Усі права захищені.
|
мапа сайту корисні посилання |