Инфаркт миокарда у больных с почечной дисфункцией. Как избежать диагностической слепоты и «терапевтического нигилизма»?Хроническая болезнь почек (ХБП) – это относительно медленно прогрессирующая патология. Скорость прогрессирования почечной дисфункции и сопутствующих нарушений зависит прежде всего от этиологии (диабетическая нефропатия, гломерулонефрит, хронический пиелонефрит, наследственные заболевания почек и т.д.). У большинства больных ухудшение функции почек происходит постепенно, на протяжении десятков лет, и только небольшая часть пациентов доживает до терминальной стадии ХБП и появления необходимости в программном диализе или пересадке почки. Но чем более выражена почечная дисфункция, тем выше риск сердечно-сосудистой патологии. Кардиологический больной с патологией почек – достаточно сложная клиническая задача даже для опытного врача. Оказание неотложной кардиологической помощи такому пациенту в случае острого кардиоваскулярного события – еще более проблемный вопрос. И с такими ситуациями в рутинной практике приходится сталкиваться постоянно: сердечно-сосудистые заболевания гораздо чаще встречаются у больных с ХБП, чем в общей популяции, и проблема острой коронарной патологии для таких пациентов не менее актуальна. Наш обзор посвящен особенностям ведения нефрологических больных при остром коронарном синдроме (ОКС). Актуальность В многочисленных исследованиях четко доказано, что почечная дисфункция – независимый предиктор кардиоваскулярной заболеваемости и смертности. Именно сердечно-сосудистые события (а не прогрессирующее ухудшение функции почек и нарушение обмена жидкостей и электролитов) являются ведущей причиной смерти больных с ХБП. Даже небольшая почечная дисфункция вне зависимости от этиологии значительно увеличивает риск артериальной гипертензии, ишемической болезни сердца (ИБС), сердечной недостаточности, кардиоваскулярной смерти (HOPE, HDFP, HOT, MRFIT и др.). Многие из больных с хронической почечной недостаточностью не доживают до терминальной стадии и появления потребности в диализе или трансплантации почки, погибая преждевременно именно от кардиоваскулярных событий. По данным Национального института США по проблемам сахарного диабета и заболеваниям почек (National Institute of Diabetes and Kidney Diseases) для пациента с ХБП риск умереть от кардиологических проблем более чем в 20 раз выше, чем вероятность достигнуть терминальной стадии болезни. И даже у пациентов с терминальной стадией ХБП сердечно-сосудистая патология обусловливает не менее трети всех госпитализаций и около 43-50% всех случаев смерти [1, 2]. Следует отметить, что в отличие от общей популяции сердечно-сосудистых больных, где наиболее актуальна проблема ОКС и других сердечно-сосудистых катастроф, для заболеваемости и смертности лиц с ХБП наблюдается некоторая диспропорция в пользу застойной сердечной недостаточности. Вклад ИБС в статистику причин смерти у нефрологических больных остается неизвестным, но, вероятно, в абсолютных цифрах он выше, чем в общей популяции (за счет более высокого сердечно-сосудистого риска в целом), а в относительных – ниже (за счет большей вероятности смерти лиц с ХБП от сердечной недостаточности). Среди лиц, получающих заместительную терапию диализом, клинически значимая ИБС выявляется в 33-46% случаев, ангиографические подтверждения поражения коронарных артерий – в 25-35% случаев; среди пациентов, перенесших трансплантацию почки, клинические и/или ангиографические подтверждения ИБС имеются в 11-15% случаев [2]. Не менее 20% всех случаев смерти при терминальной стадии почечной недостаточности обусловлены инфарктом миокарда (ИМ) [2]. Использование диализа, хотя и улучшает выживаемость в целом, не снижает риск ИМ. По данным C.A. Herzog et al. (1998), к концу первого года заместительной терапии (программный гемодиализ, перитонеальный диализ) ИМ происходит у 30% пациентов, к концу второго года – у 52%. Но эпидемиология ИМ при ХБП остается недостаточно изученной в связи с наличием многочисленных сложностей в своевременной и корректной диагностике ИМ у нефрологических больных (см. ниже «Особенности диагностики ОКС при ХБП»). Почечная дисфункция ассоциирована с более высокими уровнями летальности, а также частоты рецидивов ишемии миокарда, повторного ИМ, инсульта, серьезных геморрагических осложнений, острой сердечной недостаточности, фибрилляции предсердий и желудочков. Даже слабая и умеренно выраженная почечная дисфункция является значимым независимым предиктором риска внутрибольничной смерти и развития геморрагических осложнений у больных с ОКС (S.G. Wannamethee et al., 1997; B.F. Culleton et al., 1999; M.W. Yerkey et al., 2004; N.S. Anavekar et al., 2004; M.G. Shlipak et al., 2005, и др.), но чем более выражено нарушение функции почек, тем выше риск осложнений. Данные канадского регистра GRACE (Global Registry of Acute Coronary Events) свидетельствуют о том, что у больных ИМ с подъемом сегмента ST, не-Q-ИМи нестабильной стенокардией при скорости клубочковой фильтрации (СКФ) 30-60 мл/мин/1,73 м2 риск смерти увеличивается в 2,09 раза, при СКФ <30 мл/мин/1,73 м2 – почти в 4 раза. Особенно неблагоприятен прогноз в ранние сроки после инфаркта: внутрибольничная летальность у больных с ХБП составляет 21% по сравнению с 6-8% в общей популяции инфарктных больных [3]. По результатам исследования R.S. Wright et al. (2002) внутрибольничная летальность при ИМ составляет 2% у пациентов с нормальной функцией почек, 6% – с небольшой почечной дисфункцией, 14% – при умеренной почечной недостаточности, 21% – при тяжелой почечной недостаточности, 30% – в терминальной стадии ХБП (рис. 1). 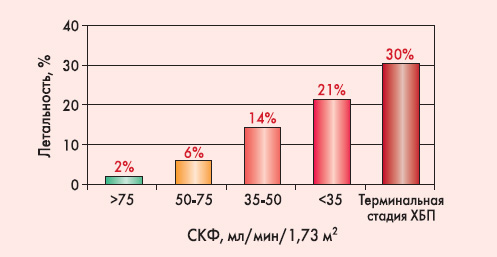 Рисунок 1. Внутрибольничная летальность при ИМ в зависимости от состояния функции почек (по R.S. Wright et al., 2002)
В течение первого года летальность при ИМ в популяции больных с терминальной стадией ХБП достигает 59%, к концу второго года – 71-74%, причем на протяжении последних нескольких десятилетий эти цифры остаются неизменными. Эксперты полагают, что такие высокие уровни летальности от ИМ на фоне почечной недостаточности в большой мере обусловлены тем, что инфаркт у таких пациентов сложнее диагностировать, и даже при установленном диагнозе большинство пациентов остаются «недолеченными». Безусловно, значительное возрастание сердечно-сосудистого риска у нефрологических больных не может не вызывать тревоги. С другой стороны, современная кардиология добилась значительных успехов в вопросах первичной и вторичной профилактики кардиоваскулярных событий, и прогресс в этом отношении впечатляющий. Это означает, что, приложив необходимые усилия, мы можем уменьшить этот риск и у сложной категории больных с ХБП, а значит – существенно повлиять на уровень их заболеваемости и летальности, улучшить прогноз и качество жизни. К сожалению, большинство публикаций, посвященных проблемам ведения пациентов с ИБС, не касаются особенностей лечения больных с сопутствующей почечной дисфункцией. Соответствующая доказательная база испытывает заметный дефицит данных по наиболее рациональным принципам лечения и профилактики ИБС у лиц с ХБП, особенно в случае развития острой коронарной патологии. У врача крайне мало достоверных данных, подтверждающих необходимость и целесообразность той или иной тактики у пациентов с ХБП. Чаще всего это ведет к тому, что врачи «перестраховываются» исходя из повышенных требований к безопасности терапии на фоне поражения почек и опасаются применять многие методы лечения и даже диагностики. Во многих случаях такой перекос в пользу безопасности лечения приводит к отсутствию адекватного лечения: больные с почечной дисфункцией далеко не всегда получают необходимую помощь в полном объеме, в том числе и реперфузию (с помощью тромболизиса или интервенционных вмешательств). Поэтому очень важно обратить внимание практического врача на текущее состояние проблемы ведения больных с ИБС на фоне ХБП, прежде всего в контексте ОКС. Четкое понимание всех преимуществ и рисков современных диагностических, лечебных и профилактических методов ведения больного с патологией почек позволит выбрать грамотную стратегию – не только безопасную, но и эффективную. Патофизиологические предпосылки Как правило, вопросы сочетанной кардиоваскулярной и почечной патологии рассматриваются в свете неблагоприятного влияния ХБП на контроль артериального давления (АД). Это обусловлено тем, что на первый план выступают нарушения ренин-ангиотензин-альдостероновой системы (РААС), которые отражаются прежде всего на риске артериальной гипертензии и сопряженных с ней проблем. Действительно, РААС является одним из наиболее мощных механизмов контроля и регуляции сосудистого тонуса, реактивности сосудов, их наполнения, гемореологии. Однако это имеет значение не только для контроля АД, но и для многих других важных процессов. Поражение этих процессов крайне неблагоприятно сказывается на функционировании всей сердечно-сосудистой системы, в том числе предрасполагает к сердечно-сосудистым катастрофам. Внезапная сердечная смерть (преимущественно аритмического генеза) встречается на терминальной стадии ХБП достаточно часто – примерно в 50% всех случаев смерти от сердечно-сосудистых причин. Причиной тому являются выраженные изменения миокарда, которые, как правило, сопутствуют тяжелой почечной недостаточности – уремическая кардиомиопатия, гипертрофия левого желудочка, систолическая дисфункция. Кроме того, в крови такого пациента обычно имеется значительный электролитный дисбаланс, который может оказывать аритмогенное действие. ОКС, как было проиллюстрировано рядом цифр выше, также может быть важной причиной гибели при ХБП. Для развития ИМ при почечной дисфункции, особенно в терминальной стадии ХБП, существует немало предпосылок. Помимо упомянутых изменений миокарда, снижающих его функциональные резервы и повышающих его потребность в кислороде и энергетических субстратах, при почечной недостаточности характерны нарушения, которые способствуют ускорению атеросклеротического процесса, нарушению гемореологии, ухудшению сосудистого тонуса и ауторегуляции перфузии миокарда. В результате повышается риск всех трех неятрогенных типов инфаркта, согласно всемирному определению ИМ 2007 г. [4] (рис. 2). 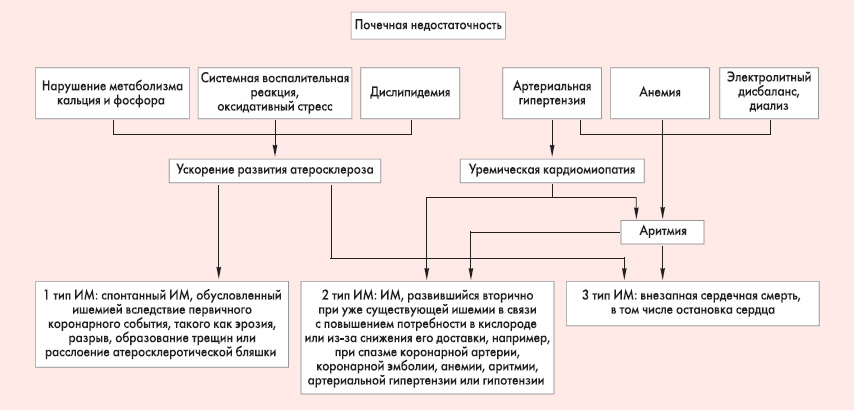 Рисунок 2. Основные патофизиологические механизмы, способствующие возрастанию риска ИМ при почечной недостаточности (по N. Johnston et al., 2008 [1])
Помимо этого, с самой процедурой диализа ассоциируются дополнительные факторы риска – гипоксия, эпизоды гипотензии, аритмические нарушения, неблагоприятные влияния некоторых диализатов и компонентов мембран. Трансплантация почки также полностью не решает все проблемы, а привносит некоторые новые, например побочные эффекты длительного применения глюкокортикоидов, дополнительные изменения липидного профиля. В результате ХБП значительно повышает риск поражения коронарных артерий и возрастания уязвимости миокарда к гипоксии и ишемии. Этот риск дополнительно увеличивается у больного пожилого возраста, при наличии сахарного диабета, сердечной недостаточности и других известных факторов высокого риска. Диагностика ОКС при ХБП: на что обратить внимание? Большинство исследователей акцентируют внимание на том, что диагностика ИМ у нефрологических пациентов отмечена рядом сложностей. У многих пациентов инфаркт даже не подозревается и выявляется уже позже, постфактум; у других необходимо очень тщательное и зачастую дорогостоящее обследование, чтобы на фоне многочисленных «фоновых» клинических, инструментальных и лабораторных изменений выявить и подтвердить наличие ишемии (некроза) миокарда. При выраженной патологии почек и, в частности, у больных на диализе, как правило, даже при отсутствии клинически значимого поражения сердца имеются разнообразные электрокардиографические (ЭКГ) аномалии, которые могут имитировать или маскировать ишемические изменения, что затрудняет диагностику, особенно в случае «немого» инфаркта. Кроме того, почечная дисфункция может обусловить повышение уровня кардиальных биомаркеров (тропонинов, креатинфосфокиназы) при отсутствии ишемии миокарда. Это объясняется и перманентным повреждением сердечной мышцы (уремическая кардиомиопатия), и замедленным выведением метаболитов из организма через почки. Тем не менее оценка содержания биомаркеров в диагностике ИМ может быть полезной, если ориентироваться не на сам факт повышения уровней биомаркеров по сравнению с референсными, а на динамику этих показателей в первые часы после предполагаемого сердечно-сосудистого события. Важно использовать определение не только тропонина Т, но и тропонина I – последний реже повышается даже при терминальной стадии ХБП в отсутствие ишемии миокарда. В силу различий кинетики эти два биомаркера по-разному реагируют на изменение функции почек. Уровень тропонина Т при почечной недостаточности может увеличиваться до 17-53%, тропонина I – до 7%. После диализа уровень тропонина Т в 86% случаев дополнительно повышается, а тропонина I – чаще снижается (A.H. Wu et al., 1997; J. Dierkes et al., 2000). Наконец, многие пациенты, пребывающие на программном гемодиализе или перитонеальном диализе, испытывают разнообразные боли, которые могут «симулировать» ишемию миокарда при отсутствии ОКС, либо наоборот – ОКС у таких больных зачастую протекает без выраженных клинических признаков, в том числе без классического болевого синдрома («немой ИМ»). По данным J. Sosnov et al. (2006) инфаркт у пациентов с ХБП почти в два раза реже проявляется типичным болевым синдромом и на 35% чаще – одышкой. Таким образом, диагностика ИМ на фоне ХБП не может с уверенностью опираться на все классические критерии – клинические, электрокардиографические, лабораторные. Учитывая эти сложности, ИМ у больных с патологией почек реже диагностируется своевременно. Важно помнить об этом и поддерживать высокую настороженность относительно возможного инфаркта у больного с ХБП, даже при отсутствии типичных признаков острой ишемии миокарда. Золотым стандартом диагностики ИМ остается коронароангиография. Раннее применение этого метода исследования позволяет при необходимости перейти к чрескожному интервенционному вмешательству на коронарных сосудах (баллонной ангиопластике, стентированию). Для нефрологических больных это также в полной мере справедливо, хотя существуют особые предостережения относительно безопасности диагностических методов, в которых используются контрастные вещества. Контраст-индуцированная нефропатия вероятна у многих пациентов с ХБП, подвергающихся ангиографии. В случае если пациент еще не нуждался в заместительном лечении, контраст-индуцированная нефропатия может значительно приблизить возникновение такой потребности, привести к необходимости преждевременного начала программного гемодиализа. По данным G. Marenzi et al. (2004), контраст-индуцированная нефропатия у пациентов с инфарктом миокарда развивается в 19% случаев проведения ангиографии, при этом риск повреждения почек контрастным веществом непосредственно зависит от тяжести почечной дисфункции: если СКФ составляет 60 мл/мин/1,73 м2 и более, то контраст-индуцированная нефропатия регистрируется у 13% пациентов, при СКФ <60 мл/мин/1,73 м2 – у 40%. Риск этой патологии возрастает у пожилых больных, в случае позднего проведения исследования (более 6 ч с начала инфаркта), при передней локализации ИМ, на фоне использования внутриаортальной баллонной контрпульсации, а также если объем контрастного вещества превышает 300 мл. Поэтому для больных с отсутствием признаков поражения коронарных артерий применение этого метода обследования (например, в качестве скринингового для выявления субклинической ИБС) нежелательно без особых показаний, особенно у молодых пациентов без дополнительных факторов риска (сахарный диабет и др.). Однако острая коронарная патология меняет для этого исследования соотношение польза/риск (в том числе с учетом риска контраст-индуцированной нефропатии). Наличие ХБП не должно быть противопоказанием для ангиографии и последующего интервенционного вмешательства на коронарных сосудах при ОКС. Снизить риск контраст-индуцированной нефропатии можно с помощью адекватной гидратации (R. Solomon et al., 1994; A.S. Abizaid et al., 1999). Следует учитывать также, что применение магнитно-резонансной томографии (МРТ) с контрастированием гадолинием не рекомендовано у пациентов с СКФ <30 мл/мин/1,73 м2, поскольку введение гадолиния ассоциировано с повышением риска нефрогенного системного фиброза или нефрогенной системной дермопатии. Вероятно, равноценной альтернативой МРТ с контрастированием для нефрологических больных сможет стать МРТ с инотропами, но этот метод диагностики еще предстоит изучить. Особенности лечения ОКС при ХБП Даже если ИМ на фоне ХБП диагностирован своевременно и правильно, у данной категории пациентов лечение и вторичная профилактика обычно проводятся гораздо менее рационально, чем в общей популяции инфарктных больных. По данным C.A. Herzog et al. (2007), пациенты, получающие заместительную терапию по поводу почечной недостаточности (гемодиализ, перитонеальный диализ), на 50% реже получают реперфузию при ИМ [3]. Ситуация с вторичной профилактикой у этой категории больных также оставляет желать лучшего: ацетилсалициловая кислота (АСК) назначается только 50-75% пациентам, β-блокаторы – 22%, статины – 26%. Это подтверждают и другие авторы: по данным A.K. Berger et al. (2003), β-блокаторы при ИМ и патологии почек назначаются на 8% меньше, АСК – на 15%, ингибиторы ангиотензинпревращающего фермента (АПФ) – на 22%. В исследовании R.S. Wright et al. (2002) было зарегистрировано снижение частоты назначения тромболитической терапии, АСК и β-блокаторов в среднем на 30%. В связи с этим получил распространение термин «терапевтический нигилизм» – неадекватное акцентирование внимания практических врачей на вопросах безопасности терапии в ущерб ее эффективности. Врачи зачастую необоснованно избегают назначения как многих медикаментов, так и интервенционных вмешательств; в итоге пациенты с хронической патологией почек, как никакая другая категория больных, остаются «недолеченными». К сожалению, к настоящему времени не проведено достаточно крупных проспективных исследований, целенаправленно спланированных для изучения этого вопроса, особенно в контексте сравнения реперфузионных методов лечения и консервативной терапии ИМ у нефрологических больных. Тем не менее существуют доказательные данные, подтверждающие, что многие агрессивные методы лечения при ИМ не ухудшают, а улучшают выживаемость даже такой сложной подгруппы пациентов, как лица с ХБП.
Реперфузия Терминальная стадия ХБП нередко расценивается как противопоказание к проведению тромболизиса при ИМ. В какой-то мере это оправдано, учитывая повышенный риск геморрагических осложнений, а также тот факт, что, как правило, у таких больных инфаркт диагностируется в среднем позже, чем в общей популяции лиц с ИМ (и, соответственно, тромболизис может быть начат в более поздние сроки). Поэтому пациенты с ИМ на фоне тяжелой патологии почек должны в первую очередь рассматриваться как кандидаты на проведение реперфузии с помощью чрескожного коронарного вмешательства (ЧКВ). Существуют доказательные данные, подтверждающие целесообразность такой тактики. Например, в обсервационном исследовании E.C. Keeley et al. (2004) было показано, что у пациентов с выраженной ХБП проведение ЧКВ при инфаркте обеспечило снижение количества неблагоприятных исходов и уровня летальности почти на 50% по сравнению с консервативным лечением; несколько меньшие преимущества были обнаружены для методики аортокоронарного шунтирования. Однако, если ЧКВ недоступно, реперфузионное лечение все равно остается более предпочтительным, чем консервативная терапия, поэтому необходимо рассмотреть возможность проведения тромболизиса. C.A. Herzog et al. (1999) показали, что тромболитическая терапия при ИМ с подъемом сегмента ST у больных, получающих диализ в связи с терминальной стадией ХБП, ассоциирована с 28% снижения относительного риска смерти от всех причин в течение 2 лет. Патология почек сама по себе даже не упоминается ни в абсолютных, ни в относительных противопоказаниях к тромболизису по поводу ИМ с подъемом ST [5], хотя, разумеется, если ХБП обусловила явные геморрагические нарушения, это необходимо учитывать. Дозы тромболитиков не нужно корригировать в зависимости от степени нарушения функции почек.
Вторичная профилактика В руководстве Европейского общества кардиологов по ведению больных с ИМ с подъемом ST (2008) вопросам лечения пациентов с почечной дисфункцией уделяется крайне мало внимания, однако все же подчеркнуто, что общие принципы, показания и противопоказания к лечению и вторичной профилактике у таких больных должны быть такими же, как и в общей популяции постинфарктных пациентов, хотя необходимо учитывать повышенный риск контраст-индуцированного повреждения почек при проведении ангиографии и ЧКВ, а также проявлять определенную осторожность при назначении таких препаратов, как ингибиторы АПФ, блокаторы рецепторов ангиотензина II, диуретики [5]. Но, конечно, для большинства необходимых препаратов рекомендуется уменьшить дозу, если СКФ <60 мл/мин/1,73 м2. Так, в исследовании R.S.Wright et al. (2002) было показано, что данной категории инфарктных больных применение АСК и β-блокаторов обусловило 30% снижения относительного риска смерти в первые 30 суток; ингибиторов АПФ – 48%. Примерно такие же данные были получены A.K. Berger et al. (2003), T.M. Keough-Ryan et al. (2005) и другими авторами, подтверждающими, что применение стандартных медикаментов при почечной дисфункции обеспечивает такие же преимущества в выживаемости, как и для постинфарктных больных с сохранной функцией почек. АСК и клопидогрель в настоящее время рекомендованы всем пациентам с ОКС, и для нефрологических больных нет оснований делать исключение. Дозы АСК, клопидогреля, тиклопидина при ХБП не меняются. Использование нефракционированного гепарина, препаратов группы низкомолекулярных гепаринов и фондапаринукса у больных с ХБП в основном также должно проводиться по общим показаниям, но с учетом необходимости корректировки дозы многих препаратов в зависимости от степени почечной дисфункции. Доза нефракционированного гепарина для больных ХБП такая же, как при сохранной функции почек. Низкомолекулярные гепарины выводятся в основном почками, поэтому для большинства препаратов этой группы при СКФ <30 мл/мин/1,73 м2 рекомендуется снижение дозы. Исключение составляет лишь тинзапарин, который не накапливается даже при СКФ 20 мл/мин. Фондапаринукс может использоваться при СКФ ≥20 мл/мин/1,73 м2. Применение блокаторов IIb/IIIa гликопротеиновых рецепторов для тяжелых нефрологических больных (креатинин плазмы крови >200 мкмоль/л) не изучалось, но для пациентов I-III стадии ХБП препараты этой группы в ряде исследований (ESPRIT и др.) подтвердили свою эффективность и безопасность (с учетом необходимости коррекции дозы в зависимости от выраженности почечной дисфункции). Прямой ингибитор тромбина – бивалирудин – также продемонстрировал свои преимущества, в том числе у пациентов с СКФ <60 мл/мин/1,73 м2. Как и в общей популяции постинфарктных пациентов, при ХБП бивалирудин при лучшем профиле безопасности обеспечивал профилактику ишемических событий в той же степени, что и комбинация нефракционированного гепарина и блокатора IIb/IIIa гликопротеиновых рецепторов. И, хотя риск геморрагических осложнений на фоне приема бивалирудина заметно возрастает при увеличении тяжести почечной дисфункции, он в любом случае остается более низким, чем в группе сравнения при тех же стадиях ХБП (метаанализ D.P. Chew et al., 2003; субанализ исследования REPLACE-2, 2005). В результате бивалирудин на сегодняшний день является одним из немногих антикоагулянтов, которые могут использоваться при любой стадии ХБП, включая терминальную (с соответствующей коррекцией дозы препарата). Очень важно обеспечить адекватный контроль различных факторов риска, прежде всего – артериальной гипертензии и сахарного диабета. Около 80% пациентов с терминальной стадией ХБП имеют повышенное АД [1], и только у небольшой части из них проводится адекватная антигипертензивная терапия, позволяющая добиваться целевых уровней АД (<125-130/80 мм рт. ст.). Основой лечения таких больных должно быть медикаментозное ингибирование РААС, что обеспечивается назначением ингибиторов АПФ и/или блокаторов рецепторов ангиотензина II. Препараты обоих классов доказали свою высокую эффективность не только в контроле АД, но и нефропротекции, в том числе для замедления скорости прогрессирования уже развившейся ХБП. К сожалению, гиперкалиемия, которая нередко сопровождает тяжелую почечную дисфункцию, ограничивает наши возможности по применению ингибиторов АПФ и титрованию их дозы до целевой. При необходимости следует прибегать к комбинированию блокаторов РААС с β-блокаторами и/или блокаторами кальциевых каналов. Особое значение имеют β-блокаторы, которые широко применяются у нефрологических больных после ИМ в том числе и в связи с повышенным риском аритмических нарушений и обусловленной ими внезапной сердечной смерти. Назначение β-блокаторов позволяет успешно бороться сразу с несколькими проблемами – артериальной гипертензией, ишемией миокарда, высоким риском аритмий. Препараты этой группы улучшают систолическую функцию левого желудочка и увеличивают выживаемость больных. В проспективном плацебо-контролируемом исследовании G. Cice et al. (2003) применение карведилола у пациентов, пребывающих на диализе в связи с терминальной стадией ХБП и имеющих дилатационную кардиомиопатию (фракция выброса левого желудочка <35%), за 2 года лечения позволило уменьшить размеры камер сердца, увеличить фракцию выброса и добиться снижения риска смерти от всех причин на 49%. Крайне важным является адекватная терапия сахарного диабета. Это имеет значение как для замедления прогрессирования поражения почек, так и для профилактики кардиоваскулярных событий. Целевые уровни гликемии такие же, как в общей популяции. Как и в общей популяции сердечно-сосудистых больных, значимой составляющей вторичной профилактики при ХБП является борьба с дислипидемией. В этом отношении целевые уровни липидов крови и предпочтительные методы лечения у нефрологических пациентов не отличаются. Целый ряд клинических исследований (HPS, ASCOT, UK-HARP, 4D и др.) подтвердил, что различные статины (аторвастатин, симвастатин, правастатин) достаточно эффективны и безопасны у больных с нарушением функции почек, в том числе на терминальной стадии ХБП. Мало того – в некоторых исследованиях было продемонстрировано, что статины за счет своих плейотропных эффектов (противовоспалительного, иммуномодулирующего) способствуют замедлению прогрессирования почечной недостаточности (CARE, GREACE и др.). Кроме того, большое значение имеют все стандартные мероприятия по модификации образа жизни (отказ от курения, достаточная физическая активность, борьба с избыточным весом), рекомендации по диете и питьевому режиму, лечение анемии, коррекция электролитных и других нарушений. Выводы Главное, что пытаются в настоящее время донести до практического врача эксперты международных кардиологических обществ, – это мысль о том, что диагностика, лечение и профилактика острых коронарных событий у больных с почечной недостаточностью должны проводиться в полном объеме и столь же активно (агрессивно), как и в общей популяции сердечно-сосудистых больных (с сохранной функцией почек). Преимущества такой стратегии для этой категории пациентов даже выше, учитывая более высокий кардиоваскулярный риск, а возможные меры осторожности не должны существенно связывать врачу руки. Прежде всего это касается реперфузионного лечения при ИМ и мероприятий вторичной профилактики. При четком выполнении всех рекомендаций по стратификации риска, подбору методов терапии и дозированию лекарственных препаратов даже больной с терминальной стадией ХБП получает значительные преимущества по ранним исходам и отдаленному прогнозу. Литература 1. Johnston N., Dargie H., Jardine A. Diagnosis and treatment of coronary artery disease in patients with chronic kidney disease. Heart 2008; 94: 1080-1088. 2. Elsner D. How to diagnose and treat coronary artery disease in the uremic patient: an update. Nephrol Dial Transplant 2001; 16: 1103-1108. 3. Herzog C.A., Littrell K., Arko C. et al. Clinical characteristics of dialysis patients with acute myocardial infarction in the United States: a collaborative project of the United States Renal Data System and the National Registry of Myocardial Infarction. Circulation 2007; 116: 1465-72. 4. Thygesen K., Alpert J.S., White H.D. et al.; on behalf of the Joint ESC/ACC/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. Eur Heart J 2007; 28 (20): 2525-2538; Circulation 2007; 116: 2634-2653. 5. Van de Werf F., Bax J., Betriu A. et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology. Eur Heart J 2008; 29: 2909-2945. 6. Mann J.F., Gerstein H.C., Dulau-Florea I., Lonn E. Cardiovascular risk in patients with mild renal insufficiency. Kidney Int Suppl 2003; (84): S192-6. 7. Mann J.F. Cardiovascular risk in patients with mild renal insufficiency: implications for the use of ACE inhibitors. Presse Med 2005; 34 (18): 1303-8. 8. Abbott K.C., Bakris G.L. What have we learned from the current trials? Med Clin North Am 2004; 88 (1): 189-207. 9. Weir M.R. Effects of renin-angiotensin system inhibition on endorgan protection: can we do better? Clin Ther 2007; 29 (9): 1803-24. Автор обзора Анна Карташева Комментарий специалиста Дмитрий Дмитриевич Иванов
Член ERA-EDTA1, На сегодня абсолютно понятно, что наличие хронической болезни почек (ХБП) значительно повышает кардиоваскулярные риски (таблица 1). При этом чем больше снижена скорость клубочковой фильтрации (СКФ), тем чаще отмечаются фатальные сердечно-сосудистые события. Более того, из всех пациентов с ХБП к диализу «приходит» лишь 1%, все остальные погибают от целого ряда причин, лидируют среди которых именно кардиоваскулярные. Наиболее очевидным фактором, объясняющим такое развитие событий, является эндотелиальная дисфункция. Ведь именно почки являются органом с наибольшей в организме микрососудистой системой. Таким образом, ХБП снижает функциональный резерв организма в формировании исходов кардиоваскулярных событий. Поэтому тема, рассматриваемая в приведенной статье, представляется нефрологам чрезвычайно актуальной. Обсуждение этой проблемы является междисциплинарным подходом, в котором и нефролог, и кардиолог заинтересованы в принятии согласованных решений. Неоспорима практическая необходимость как постоянных консультаций кардиолога в отделении нефрологии/диализа, так и приглашения нефролога в отделение острой коронарной патологии для совместного ведения пациентов. Применительно к реалиям нашей страны необходимо отметить следующее. Чаще всего мы встречаемся с развитием острого коронарного синдрома (ОКС) у пациентов, еще не получающих почечнозаместительную терапию (диализ и трансплантация). Ведущей причиной неблагоприятных исходов у таких больных являются прежде всего инфаркт миокарда и аритмия. Нефролога наиболее часто приглашают в отделение интенсивной терапии для консультации пожилых пациентов с хронической сердечной недостаточностью на фоне ХБП. В этих случаях мы сталкиваемся с явлениями нарастающей почечной недостаточности на фоне снижения фракции выброса и нормо-/гипотензии. Такая клиническая картина отражает развитие ишемической нефропатии, нередко на фоне атеросклеротической ишемической болезни почек.
Гораздо реже, что связано с относительной немногочисленностью в Украине группы диализных пациентов (чуть более 3 тыс.) и лиц с трансплантированной почкой (более 500), развитие ОКС происходит в центрах диализа. К сожалению, диагностические подходы в ведении нефрологических пациентов с признаками ОКС пока далеки от совершенства (NB: помните о важности исследования тропонина І), отсутствуют и единые протоколы лечения таких пациентов. Какая лечебная тактика может считаться оправданной? В дополнение к уже приведенным в статье подходам необходимо отметить следующие важные моменты. Как неотложная терапия для восстановления перфузии почек и снижения (или, по крайней мере, предупреждения нарастания) уровней креатинина и мочевины в крови показаны почечные дозы допамина (0,5-1,5 мкг/кг/мин) либо добутамина (дополнительное воздействие на сердечную мышцу). Такая терапия может быть осуществлена при отсутствии противопоказаний (например, в первые сутки после ОКС) длительностью до 24 ч в первом введении и по 12-16 ч – в последующие дни. Кроме того, накапливается успешный опыт применения негликозидного кардиотоника левосимендана (к сожалению, ввиду высокой стоимости использование препарата практикуется пока преимущественно в условиях частных клиник, например «Борис» и «Медиком» в Киеве). Его введение может осуществляться болюсно либо в виде медленной внутривенной инфузии со скоростью 10 мкг/кг/мин (более щадящая тактика, но с отсроченным формированием эффекта). Препарат показал хорошую переносимость и убедительный эффект у пациентов с диастолической дисфункцией в восстановлении диуреза и снижении уровня азотистых шлаков. В плановой терапии, безусловно, мы опираемся на кардиологические рекомендации ведения пациентов с ОКС на фоне ХБП. Нарушение функции почек вносит коррекцию в возможность применения стандартных доз ингибиторов АПФ, β-блокаторов и диуретиков. При этом существует две принципиальные возможности, а именно: снижение дозы препарата наполовину (для большинства средств) или переход на препараты с двойным/внепочечным путем выведения без коррекции их дозировки. Среди ингибиторов АПФ не требует снижения дозы моэксиприл, практически не требуют – фозиноприл и квадроприл; среди β-блокаторов могут безопасно использоваться небиволол, бисопролол; αβ-блокаторов – карведилол; диуретиков – ксипамид (большие дозы показаны при меньшей СКФ) и торасемид. В свете результатов исследования ОNTARGET двойная блокада РААС с помощью комбинации блокатора рецептора ангиотензина II и ингибитора АПФ у пожилых пациентов со сниженной СКФ, вероятно, не оправдана. Удачной комбинацией (при наличии показаний) можно считать такую: ингибитор АПФ + блокатор кальциевых каналов (или β-блокатор) + тиазидоподобный диуретик (или торасемид). Дозы антитромбоцитарных препаратов не меняются. Возможно, перспективным будет использование прямого ингибитора ренина и эплеренона (селективного блокатора альдостероновых рецепторов). Назначение статинов, вероятно, не столь оправдано или, во всяком случае, не приоритетно, так как при ХБП отмечаются парадоксальные эпидемиологические особенности – у более тучных пациентов с повышенными уровнями холестерина была показана лучшая выживаемость. Значительно осложняет течение острой кардиологической патологии на фоне ХБП наличие синдрома кардиоренальной анемии и ряда других осложнений. Поэтому важным является осторожное использование эритропоэтина и препаратов железа, активного метаболита витамина D (после исследования уровня паратгормона), незаменимых аминокислот (с ограничением потребления белка животного происхождения). Даже если после перенесенного ОКС на фоне ХБП имеет место благоприятный исход, такой пациент требует неустанного наблюдения нефролога с коррекцией терапии в соответствии с состоянием функции почек. Активно проводящиеся в настоящее время кардиологические исследования обеспечивают постоянное пополнение доказательной базы по пациентам с почечной дисфункцией, а задача нефролога – умело их использовать.
1 European Renal Association – European Dialysis and Transplant Association. Medicine Review 2008; 5 (05): 25-31 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |