Кардиогенный шок у инфарктных больных: что нового?Кардиогенный шок – это острое нарушение перфузии тканей организма, вызванное значительным повреждением миокарда и нарушением его сократительной функции. К основным причинам кардиогенного шока относятся инфаркт миокарда (ИМ), миокардиты, кардиомиопатии, токсические поражения миокарда, опухоли сердца, тяжелые пороки сердца, травма, тампонада перикарда, тромбоэмболия легочной артерии, тяжелое нарушение сердечного ритма. Наиболее часто практическому врачу приходится сталкиваться с кардиогенным шоком у больных с острым коронарным синдромом (ОКС), прежде всего при ИМ с подъемом сегмента ST. Кардиогенный шок – ведущая причина смерти больных ИМ. Обычно кардиогенный шок развивается в первые часы после появления первых симптомов ИМ и значительно реже – в более поздний период. Риск развития этого грозного осложнения и его тяжесть во многом определяются обширностью инфаркта – размерами пострадавшего от ишемии и некроза миокарда. Поэтому чаще всего кардиогенный шок развивается при ИМ передней стенки левого желудочка, верхушки сердца и передней части межжелудочковой перегородки, то есть при окклюзии левой коронарной артерии, которая обеспечивает кровью большую часть массы миокарда, а также при поражении всех трех основных венечных артерий (что обусловливает вовлечение в зону инфаркта более 40% массы миокарда левого желудочка). Кардиогенный шок при ИМ правого желудочка бывает значительно реже (рис. 1). 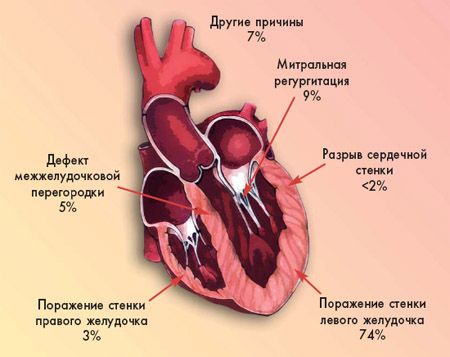 Рисунок 1. Роль различных механизмов,ответственных за развитие кардиогенного шока при ИМ (по C.H. Davies, 2001) [7]
Самой большой проблемой при кардиогенном шоке является следующий порочный круг: выраженное угнетение систолической функции и снижение артериального давления (АД) обусловливают неэффективность коронарной перфузии, в результате коронарный кровоток еще больше ухудшается, а ишемия и некроз миокарда прогрессивно усугубляются, что дополнительно ухудшает насосную функцию левого желудочка. Если масса некротизированного миокарда составляет 40-50% и более, то, как правило, кардиогенный шок становится ареактивным (торпидным), то есть таким, при котором введение инотропов и вазопрессоров не дает эффекта. Летальность в этой группе больных приближается к 100%. Есть ли какие-то положительные тенденции в решении проблемы кардиогенного шока в последние годы? Какие возможности современная медицина может предложить для рутинной практики ведения больных с этим осложнением? Мы подобрали основные доказательные данные и практические рекомендации, посвященные этому актуальному вопросу, и представляем их краткий обзор в этой статье. Кардиогенный шок вчера и сегодня Частоту развития кардиогенного шока у больных ОКС точно определить сложно, поскольку разные авторы используют разные определения и критерии диагностики шока. По приблизительным оценкам десятилетней давности (GUSTO-I, 1996; GUSTO-III, 1999; R.J. Goldberg et al., 1999), кардиогенный шок развивался у 7-10% пациентов с ОКС. Позже различные популяционные исследования показывали уже чуть более низкую встречаемость кардиогенного шока при ОКС – от 3,2 до 8,6% (TRACE, 2003; NRMI, 2005; J. Fang et al., 2006; GRACE, 2007). В некоторых из этих исследований положительная динамика риска кардиогенного шока, отмеченная за последние несколько лет, четко ассоциировалась с внедрением современных научно-обоснованных рекомендаций по ведению больных ОКС [2, 3], прежде всего – с более широким использованием методов реваскуляризации коронарных сосудов, особенно хирургических, а также поддержки гемодинамики с помощью внутриаортальной баллонной контрпульсации. Наиболее ценно в достижениях современной кардиологии то, что они выражаются не только в более низком риске кардиогенного шока, но и в снижении летальности при этом осложнении. Совсем недавно кардиогенный шок фактически был приговором. До внедрения в практику современных методов лечения ИМ (ургентной реваскуляризации, внутриаортальной баллонной контрпульсации) развитие кардиогенного шока обрекало на летальный исход почти всех пациентов – порядка 85-95% (E. Braunwald, 1988). Как показал ряд исследований последних лет (NRMI, 2005; J. Fang et al., 2006; AMIS Plus, 2008), летальность при кардиогенном шоке возможно снизить до 30-40%, хотя на практике реальные цифры летальности даже в развитых странах мира пока остаются на уровне 50-60%. В последнем руководстве Европейского общества кардиологов (European Society of Cardiology, ESC) по ведению больных с сердечной недостаточностью (СН) (2008) [4] указано, что внутрибольничная летальность лиц с кардиогенным шоком составляет 40-60%. Так, результаты американского национального регистра по ИМ (National Registry of Myocardial Infarction, NRMI) показали, что внутрибольничная летальность среди больных с кардиогенным шоком, развившемся в связи с ИМ с подъемом ST, снизилась с 60,3% в 1995 г. до 47,9% в 2004 г. (p<0,001). Это увеличение выживаемости пациентов было ассоциировано с удвоением количества чрескожных коронарных вмешательств (ЧКВ), используемых для ургентной реваскуляризации коронарных артерий (27,4% в 1995 г. и 54,4% в 2004 г., p<0,001). В швейцарском регистре AMIS Plus были получены похожие данные – отмечено снижение летальности при кардиогенном шоке за последние 10 лет с 62,8 до 47,7% (p=0,01), которое связывается со значительным ростом количества ЧКВ при ОКС (с 7,6 до 65,9%, p=0,01) [5]. В 1999 г. исследование SHOCK [6] показало, что ургентная реваскуляризация (ангиопластика или аортокоронарное шунтирование) при ОКС, осложненном кардиогенным шоком, хотя и не приводит к достоверному снижению ранней (1-месячной) летальности по сравнению с группой медикаментозного лечения, но статистически значимо улучшает прогноз в отдаленные сроки. Летальность таких больных в течение первого полугодия после ИМ уменьшилась с 63,1 до 50,3% (p=0,027), в течение 1 года – с 66,4 до 53,3% (р<0,03). Наибольшие преимущества реваскуляризации были отмечены для подгруппы больных моложе 75 лет. По результатам этого исследования было настоятельно рекомендовано шире использовать хирургические методы ранней реваскуляризации коронарных артерий у больных с кардиогенным шоком на фоне ОКС [2]. Тромболизис менее эффективен для реваскуляризации в случае кардиогенного шока, поскольку низкое перфузионное давление препятствует адекватной доставке фибринолитика в коронарные артерии. Однако и тромболитическая терапия, по данным исследования GUSTO-I, дает снижение частоты встречаемости кардиогенного шока до 7,2%, а летальности при этом осложнении – до 55%. Другие исследования также подтвердили достоверное улучшение выживаемости больных с кардиогенным шоком на фоне применения тромболизиса по сравнению с консервативной терапией (без реваскуляризации). Поэтому тромболизис в условиях недоступности ЧКВ и ургентного аортокоронарного шунтирования является оптимальным методом лечения, особенно учитывая то, что тромболизис можно провести в гораздо более короткие сроки, в том числе и на догоспитальном этапе, что для больных с кардиогенным шоком может иметь жизнеспасающее значение. Для реалий отечественной медицины в настоящее время это более приемлемая стратегия лечения, хотя и не оптимальная, разумеется, по сравнению с ЧКВ и аортокоронарным шунтированием. Наряду с этим было подтверждено, что у пациентов с ИМ, перенесших кардиогенный шок и выживших в ранние сроки, отдаленные клинические исходы существенно не отличаются от таковых у больных без кардиогенного шока в анамнезе (SHOCK, 2006; M. Singh et al., 2007). Поэтому мероприятия, обеспечивающие улучшение ранней (внутрибольничной) выживаемости больных с кардиогенным шоком, фактически уравнивают дальнейшие риски пациентов независимо от наличия шока в анамнезе. Регистр AMIS Plus: 10 лет, отмеченные прогрессом в лечении и профилактике кардиогенного шока Для иллюстрации приведенных выше данных хотелось бы подробнее рассказать о результатах, которые были получены в рамках швейцарского регистра по ИМ (Acute Myocardial Infarction in Switzerland, AMIS Plus) [5]. В регистр было включено более 23,6 тыс. больных ОКС (с и без подъема сегмента ST) из 70 клиник Швейцарии. Анализировались данные с 1 января 1997 по 31 декабря 2006 года. Авторы оценили изменение частоты развития кардиогенного шока и летальности при этом осложнении в течение исследуемого периода времени и определили зависимость этих изменений от характера лечения пациентов. Оказалось, что в течение последних 10 лет частота развития кардиогенного шока у больных ОКС уменьшилась с 12,9 до 5,5% (p=0,001). Произошло это за счет уменьшения риска развития кардиогенного шока во время лечения в стационаре (с 10,6 до 2,7%, p<0,001), в то время как частота регистрации уже развившегося кардиогенного шока в момент поступления в стационар существенно не изменилась – около 2-2,3% (рис. 2). 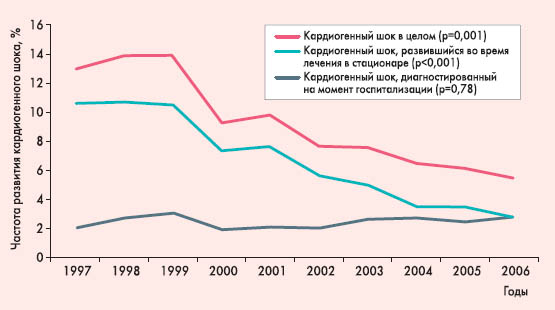 Рисунок 2. Динамика изменения частоты развития кардиогенного шока у пациентов с ОКС с 1997 по 2006 год (по данным регистра AMIS Plus [5])
Хотя кардиогенный шок в 2 раза чаще встречался у больных ОКС с подъемом ST, чем без подъема ST, снижение риска его развития за истекшее десятилетие было примерно одинаковым в обеих когортах больных. Значительно уменьшилась также внутрибольничная летальность больных с кардиогенным шоком – с 62,8 до 47,7% (p=0,01), причем это касалось как больных, поступивших с кардиогенным шоком (с 73,8 до 46,6%, p=0,009), так и тех, у кого кардиогенный шок развился уже после госпитализации (с 60,9 до 48,9%, p=0,094), хотя, как видно, у последней подгруппы больных различия не достигли статистической значимости (рис. 3). 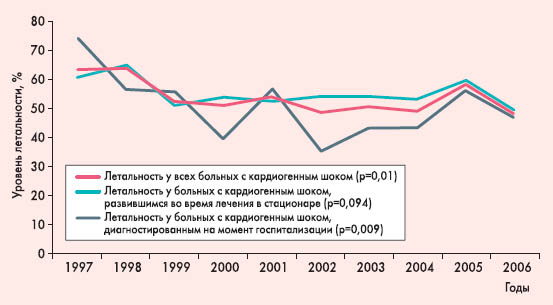 Рисунок 3. Динамика изменения летальности у больных с кардиогенным шоком на фоне ОКС с 1997 по 2006 год (по данным регистра AMIS Plus [5])
Анализ данных AMIS Plus [5] указывает на то, что положительные тенденции в динамике риска кардиогенного шока и связанной с ним летальности у больных ОКС коррелируют с совершенствованием стационарной помощи таким пациентам, в частности с широким внедрением хирургических методов реваскуляризации. Следует отметить, что в изучаемых клиниках за время исследования значительно увеличилось количество проведенных ЧКВ (с 7,6 до 65,9%, p=0,01) и использование внутриаортальной баллонной контрпульсации, в то время как количество тромболизисов снизилось, а количество операций аортокоронарного шунтирования практически не изменилось (рис. 4). 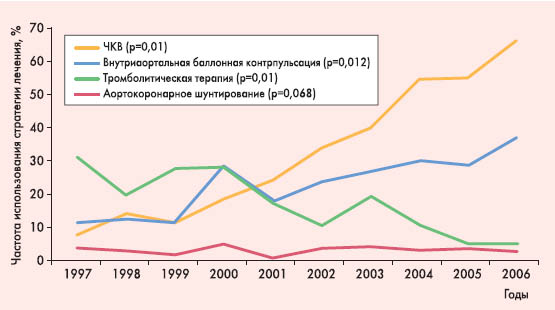 Рисунок 4. Динамика изменения частоты использования различных вмешательств у пациентов с ОКС по данным регистра AMIS Plus [5]
Анализ показал, что на снижении как внутрибольничной летальности больных ОКС в целом, так и внутрибольничной летальности в подгруппе пациентов с кардиогенным шоком достоверно отразилось именно более широкое использование ЧКВ. Кроме того, существенно улучшилось терапевтическое лечение пациентов с кардиогенным шоком: в течение изучаемого периода времени в этой когорте больных возросло использование ацетилсалициловой кислоты (с 80,4 до 89,2%), клопидогреля (с 11,7 до 65,5%), ингибиторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов (с 11,8% в 1999 г. до 35,6% в 2006 г.), липидоснижающих препаратов (с 14,3% в 1999 г. до 77,8% в 2006 г.), β-блокаторов (с 32,7 до 40%). В рамках регистра AMIS Plus [5] были изучены также факторы риска развития кардиогенного шока. Оказалось, что независимыми предикторами этого осложнения были пожилой возраст, подъем сегмента ST, тахикардия, низкое систолическое АД. Напротив, использование липидоснижающих препаратов и проведение ЧКВ достоверно ассоциировались с более низким риском кардиогенного шока. Практические рекомендации по ведению больных с кардиогенным шоком
Диагностика Быстрая диагностика кардиогенного шока позволяет своевременно принять необходимые меры и предотвратить гибель пациента. Поэтому очень важно знать те признаки, которые с наибольшей вероятностью указывают на развитие этого осложнения. Для оценки выраженности острой СН у больных ИМ используются классификации T. Killip (1967) и J.S. Forrester (1977) [4]. Обе классификации подразумевают деление пациентов на 4 группы (стадии, классы) в зависимости от выраженности нарушений системной гемодинамики и застоя в легких. Отличия между ними состоят в том, что в классификации J.S. Forrester учитываются не только клинические признаки, как в классификации T. Killip, но и некоторые показатели центральной гемодинамики (давление «заклинивания» в легочной артерии, сердечный индекс). По классификации T. Killip, состоянию кардиогенного шока соответствует снижение АД <90 мм рт. ст. и наличие признаков периферической вазоконстрикции (олигурия, цианоз, потливость); по классификации J.S. Forrester – признаки сниженной перфузии тканей организма в сочетании с высоким давлением «заклинивания» в легочной артерии. В обновленном в конце 2008 г. руководстве ESC по ведению больных ИМ с подъемом ST [1], кардиогенный шок определяется снижением систолического АД <90 мм рт. ст., повышением давления наполнения желудочков сердца (и, соответственно, давления «заклинивания» легочной артерии) >20 мм рт. ст., уменьшением сердечного индекса <1,8 л/мин/м2. Диагноз кардиогенного шока устанавливается в том случае, если исключены другие возможные причины гипотензии (гиповолемия, вазовагальный рефлекс, электролитный дисбаланс, побочный эффект фармпрепаратов, тампонада миокарда). Но при этом следует помнить, что кардиогенный шок составляет около 80% всех шоковых состояний, осложняющих течение ИМ, то есть именно эта патология является наиболее вероятной, если речь идет о значительной гипотензии и гипоперфузии у инфарктных больных. Согласно новому руководству ESC по ведению больных с СН (2008) [4] кардиогенный шок не имеет четких критериев диагностики, хотя в типичных случаях о нем можно говорить, когда АД уменьшается ниже 90 мм рт. ст. (или среднее АД падает более чем на 30 мм рт. ст.), а диурез отсутствует или резко снижен (<0,5 мл/кг/ч). За короткое время появляются клинические признаки гипоперфузии органов и застоя в легких. Часто развиваются нарушения сердечного ритма. Таким образом, для первичной диагностики кардиогенного шока (у постели больного) достаточно обнаружить угрожающие клинические признаки, измерить АД и исключить другие вероятные причины гипотензии. Снижение объема выводимой мочи, которое можно оценить после катетеризации мочевого пузыря, достаточно быстро подтверждает, в правильном ли направлении движется диагностический поиск. Кроме того, как для диагностики шока, так и для контроля эффективности лечения крайне важно инвазивное исследование параметров центральной гемодинамики. С этой целью рекомендована катетеризация правых отделов сердца и легочной артерии (баллонный «плавающий» катетер Swan-Ganz). При этом измеряется давление в правом предсердии и желудочке, легочной артерии, давление «заклинивания» легочной артерии, сердечный выброс. Эти данные позволяют наиболее точно оценить состояние функции сердца и дают возможность заметить ее минимальное ухудшение или улучшение, а также исключить многие другие возможные причины гипотензии. Важно напомнить, что ИМ правого желудочка иногда манифестирует как кардиогенный шок, но подходы к лечению обоих состояний существенно отличаются. Поэтому при подозрении на кардиогенный шок необходима также дифференциальная диагностика с инфарктом стенки правого желудочка. С этой целью могут помочь выявление набухания шейных вен (особенно на вдохе), подтверждение отсутствия влажных хрипов в легких, ЭКГ-признаки ИМ правого желудочка (например, подъем сегмента ST в отведении V4, характерные изменения при записи грудных отведений ЭКГ справа), ультрасонографические доказательства правостороннего инфаркта.
Профилактика и лечение На сегодняшний день единственным подходом, четко подтвердившим возможность снижения риска кардиогенного шока у больных с ОКС, является как можно более раннее проведение реваскуляризации коронарных сосудов. Как показывают клинические исследования и крупные регистры, рекомендуемая в настоящее время стратегия ургентной реперфузии – наилучший способ уменьшить количество пациентов с кардиогенным шоком. Лечение кардиогенного шока представляет собой задачу сложную, но не безнадежную. Как было показано выше, некоторые лечебные мероприятия при ОКС уже доказали свои значительные преимущества не только в профилактике кардиогенного шока, но и в улучшении выживаемости в случае развития этого осложнения. Это касается прежде всего стратегии ранней реваскуляризации, использование которой ассоциировано с лучшими исходами для больных с манифестировавшим кардиогенным шоком. Снижение внутригоспитальной летальности у больных с кардиогенным шоком на фоне использования ЧКВ было убедительно показано в регистре AMIS Plus (2008) [5], положительное влияние на более отдаленные исходы (6 месяцев) – в исследовании SHOCK (1999) [6]. На основании полученных в исследовании SHOCK данных разработчики американских рекомендаций по лечению ИМ (American College of Cardiology, ACC; American Heart Association, AHA) отнесли экстренную реваскуляризацию при кардиогенном шоке к рекомендациям I класса [2]. В руководстве ESC по ведению больных с ИМ с подъемом сегмента ST (2008) [1] ранняя реваскуляризация с помощью ЧКВ является рекомендуемой стратегией в случае развития кардиогенного шока (класс рекомендаций I, уровень доказательности В). Если ЧКВ не может быть проведено или доступно только после некоторой задержки, пациентам с кардиогенным шоком может быть показано немедленное проведение аортокоронарного шунтирования, особенно если есть и другие показания к операции на сердце (митральная регургитация, разрыв стенки левого желудочка и т.д.). Если же и ЧКВ, и аортокоронарное шунтирование невозможны в ближайшее время, необходима ранняя реваскуляризация с помощью тромболизиса. Раннее и эффективное устранение ишемии миокарда и предотвращение формирования некроза или значительное ограничение его размеров обеспечивают быстрое восстановление систолической функции сердца и тем самым разрывают замкнутый круг «угнетение сердечного выброса → снижение перфузии → дополнительное ухудшение состояния миокарда». Кроме того, для прерывания этого же порочного круга очень важны мероприятия по гемодинамической поддержке для удержания АД на уровне, который обеспечивает адекватную перфузию жизненно важных органов, прежде всего самого миокарда (90-100 мм рт. ст.). Для этого используются инотропные препараты, вазопрессоры, внутриаортальная баллонная контрпульсация. Руководства ESC по ведению больных ИМ с подъемом ST (2008) [1] и по ведению больных СН (2008) [4] для лечения кардиогенного шока, кроме ранней реваскуляризации, рекомендуют использование оксигенотерапии, искусственной вентиляции легких в зависимости от уровня газов крови, оценку состояния гемодинамики с помощью катетеризации сердца, введение инотропов (допамина, добутамина), применение внутриаортальной баллонной контрпульсации и механических устройств для обеспечения функции левого желудочка. На сегодняшний день нет доказательств того, что инотропные препараты улучшают выживаемость больных с кардиогенным шоком. Но инотропы могут либо улучшить клиническое состояние пациента и вывести его из шока, либо, по крайней мере, стабилизировать его гемодинамику до того момента, как будет возможным использовать более эффективные методы (внутриаортальная баллонная контрпульсация, хирургическое вмешательство, специальные механические устройства). Наиболее популярным инотропом является допамин, особенно учитывая то, что в низких дозах он эффективно улучшает почечную перфузию, не влияя существенно на системную гемодинамику. У добутамина есть свои преимущества – хотя он является несколько более слабым инотропом, чем допамин, он снижает давление в легочной артерии. Но следует помнить, что назначение инотропов, особенно допамина в высоких дозах, увеличивает риск развития тахикардии и аритмии, поэтому они должны с осторожностью использоваться у больных с ускоренной частотой сердечных сокращений и требуют мониторинга ЭКГ. Часто применяется комбинация низких доз допамина с более высокими дозами добутамина – это позволяет с минимальным риском побочных эффектов улучшить системную гемодинамику и особенно перфузию почек. Основными критериями эффективности инотропной терапии являются повышение систолического АД выше 90 мм рт. ст., увеличение сердечного индекса >2 л/мин/м2, снижение давления «заклинивания» легочной артерии до 20 мм рт. ст., увеличение диуреза. При этом важно, чтобы частота сердечных сокращений не превышала 100 уд/мин. Если развивается тахикардия или нарушения сердечного ритма, дозы инотропов необходимо по возможности снизить. Если инотропы в стандартных дозах оказались недостаточно эффективными, возможны следующие варианты изменения тактики: повышение дозы используемого инотропа, комбинация двух инотропов, добавление вазопрессоров, использование внутриаортальной баллонной контрпульсации, специальных механических устройств для поддержки функции левого желудочка. Вазопрессоры (норадреналин) не рекомендованы в качестве терапии первой линии острой СН, но в случае кардиогенного шока могут быть показаны, если инотропы в комбинации с адекватной инфузионной терапией оказались недостаточно эффективными в стабилизации гемодинамики. При этом использовать вазопрессоры необходимо с большой осторожностью, поскольку кардиогенный шок, как правило, сопровождается периферической вазоконстрикцией и высоким периферическим сосудистым сопротивлением. К тому же норадреналин способствует лактатному ацидозу, повышает давление в легочной артерии (может спровоцировать отек легких) и отличается тем, что к нему быстро развивается толерантность. Поэтому, даже если пришлось прибегнуть к норадреналину, важно отменить его по возможности как можно раньше. Применение адреналина для лечения кардиогенного шока не рекомендовано; показания к его введению должны быть ограничены только случаями остановки сердца. Методом временной поддержки гемодинамики, достоверно улучшающим выживаемость больных с кардиогенным шоком, является внутриаортальная баллонная контрпульсация. Однако следует отметить, что доказательные данные, свидетельствующие о клинических преимуществах метода, несколько противоречивы. Тем не менее исследование SHOCK показало снижение летальности больных с кардиогенным шоком при использовании контрпульсации, в том числе и в комбинации с тромболитической терапией [6]. В случае если пациент не отвечает на стандартную терапию, показано применение механических устройств для обеспечения функции левого желудочка, хотя доказательная база по этой стратегии нуждается в дополнительных исследованиях. Как и внутриаортальная баллонная контрпульсация, использование этих устройств, частично или полностью замещающих насосную функцию левого желудочка, позволяет выиграть время, поддержать гемодинамику пациента до ее стабилизации либо до того, как появится возможность решить проблему более радикальным путем. Если кардиогенный шок обусловлен разрывом стенки миокарда, отрывом сосочковой мышцы, митральной регургитацией или другими серьезными изменениями структуры сердца, то единственным шансом на спасение пациента является безотлагательное оперативное вмешательство. Из медикаментозных средств также может быть полезным назначение ингибиторов IIb/IIIa гликопротеиновых рецепторов тромбоцитов. Эти препараты продемонстрировали определенные преимущества в профилактике феномена «no-reflow» после реваскуляризации и потому в наибольшей степени показаны больным, для которых адекватная реперфузия имеет жизнеспасающее значение, то есть в первую очередь для пациентов с кардиогенным шоком. Например, в исследовании CAPTURE (1996) применение абсиксимаба в комбинации с ургентной коронарной ангиопластикой комбинированная конечная точка (смерть + повторный ИМ + повторная ургентная ангиопластика) составила 8,5% по сравнению с 20,4% в группе сравнения (р=0,05). Исследования EPIC, EPILOG, EPISTENT подтвердили схожие преимущества комбинирования абсиксимаба с ЧКВ. Изучаются также некоторые инновационные подходы, например использование никорандила, ингибиторов NO-синтазы, ингибиторов Na+/K+-насоса, глюкозо-инсулин-калиевой смеси и др. Но целесообразность их использования у больных с кардиогенным шоком еще должна быть подтверждена в достаточно крупных рандомизированных исследованиях. До выведения больного из состояния кардиогенного шока не следует применять без особых показаний β-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензинпревращающего фермента, сердечные гликозиды, глюкокортикостероиды. Инфузионная терапия при кардиогенном шоке должна быть очень осторожной, проводиться в небольших объемах (в отличие от стратегии лечения ИМ правого желудочка, когда пациенту показана быстрая объемвосполняющая терапия). Литература 1. Van de Werf F., Bax J., Betriu A. et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology. Eur Heart J 2008; 29: 2909-2945. 2. Antman E.M., Anbe D.T., Armstrong P.W. et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction – executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Circulation 2004; 110: 588-636. 3. Van de Werf F., Ardissino D., Betriu A. Et al. Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J 2003; 24: 28-66. 4. Task Force for Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of European Society of Cardiology, Dickstein K., Cohen-Solal A., Filippatos G. et al.; ESC Committee for Practice Guidelines, Vahanian A., Camm J., De Caterina R. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008; 29 (19): 2388-442; Eur J Heart Fail 2008; 10 (10): 933-89. 5. Jeger R.V., Radovanovic D., Hunziker P.R. et al.; for the AMIS Plus Registry Investigators. Ten-Year Trends in the Incidence and Treatment of Cardiogenic Shock. Ann Intern Med 2008; 149 (9): 618-26. 6. Hochman J.S., Sleeper L.A., Webb J.G. et al.; for The SHOCK Investigators. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341 (9): 625-34. 7. Davies C.H. Revascularization for cardiogenic shock. Q J Med 2001; 94: 57-67. 8. Topalian S., Ginsberg F., Parrillo J.E. Cardiogenic shock. Crit Care Med 2008; 36 (1 Suppl): S66-74. 9. Sanborn T.A., Feldman T. Management strategies for cardiogenic shock. Curr Opin Cardiol 2004; 19 (6): 608-12. 10. Lee K.W., Norell M.S. Cardiogenic shock complicating myocardial infarction and outcome following percutaneous coronary intervention. Acute Card Care 2008; 10 (3): 131-43. 11. Mann H.J., Nolan P.E. Jr. Update on the management of cardiogenic shock. Curr Opin Crit Care 2006; 12 (5): 431-6. 12. Duvernoy C.S., Bates E.R. Management of cardiogenic shock attributable to acute myocardial infarction in the reperfusion era. J Intensive Care Med 2005; 20 (4): 188-98. Автор обзора Анна Карташева Medicine Review 2008; 5 (05): 19-24 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2024. Усі права захищені.
|
мапа сайту корисні посилання |